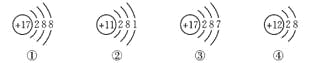
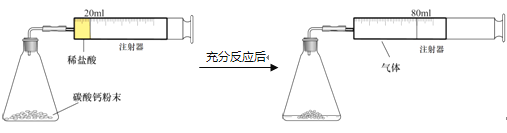
题目内容
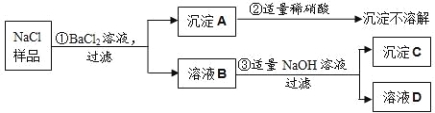
【题目】(8分)有某固体混合物,已知该混合物中可能含有FeCl3、NaCl、NH4NO3、CuSO4四种物质中的两种或多种。为探究其组成,做了如下实验(设过程中所有发生的反应都恰好完全反应)。试根据实验过程和发生的现象填写以下空白:
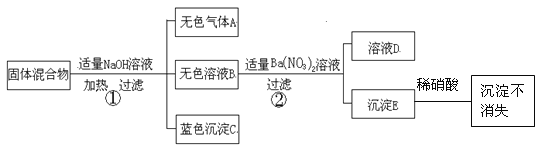
(1)用湿润的红色石蕊试纸测试气体A,试纸变__________色;C的化学式为: 。
(2)固体混合物里.上述四种物质中,肯定不存在的物质是______________(写化学式)。
(3)在溶液D中,一定含有的阴离子是(写离子符号)_____________。
(4)步骤②中发生反应的化学方程式为______________________________________。
(5)固体混合物里,上述四种物质中,还不能确定存在的物质是(写化学式)________,要进一步确定该固体混合物成分,可用溶液D再实验,请简要说明实验操作步骤、发生的现象及结论 。
【答案】(1)蓝;![]() ;(2)
;(2)![]() ;(3)
;(3)![]() ; (4)
; (4)![]() ;
;
(5) ![]() ;取少量D溶液,向其中滴加少量硝酸银溶液,若出现白色沉淀,则原固体中含有氯化钠,反之则不含;
;取少量D溶液,向其中滴加少量硝酸银溶液,若出现白色沉淀,则原固体中含有氯化钠,反之则不含;
【解析】
试题分析:硝酸铵和氢氧化钠反应会生成氨气,硫酸铜和氢氧化钠反应会生成蓝色的氢氧化铜沉淀,氯化铁和氢氧化钠反应会生成红褐色的氢氧化铁沉淀,固体混合物和氢氧化钠加热会生成无色气体和蓝色沉淀,则说明混合物中含有硝酸铵和硫酸铜,而不含有氯化铁;无色溶液B中加热硝酸钡生成的沉淀E不溶于稀硝酸,故溶液B中一定含有硫酸根离子,再次证明混合物中含有硫酸铜;
(1)硝酸铵和氢氧化钠生成的气体是氨气,氨气溶于水溶液显碱性,可以使湿润的红色石蕊试纸变蓝;(2)因为无红褐色沉淀生成,故不会含有氯化铁;(3)混合物中一定含有硝酸铵和硫酸铜,加入氢氧化钠会生成硝酸钠和硫酸钠,而硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,故在溶液D中,一定含有硝酸钠,则一定含有的阴离子硝酸根离子;(4)步骤②中发生反应是硫酸钠和硝酸钡生成硫酸钡沉淀和硝酸钠;(5)因为氯化钠不参加化学反应,故固体混合物里,还不能确定存在的物质是氯化钠;要进一步确定该固体混合物是否含有氯化钠,可向溶液D加入硝酸银和稀硝酸的混合液体,若有白色沉淀生成则说明含有氯化钠,反之不含有氯化钠;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
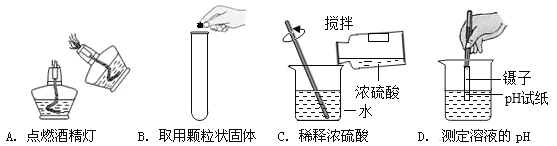
小学生10分钟应用题系列答案【题目】化学是一门以实验为基础的科学,请结合图示回答问题:
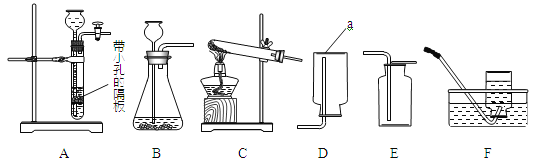
①写出仪器a的名称 (6) 。
②实验室用大理石和稀盐酸制取二氧化碳,发生反应的化学方程式为 (7) ;
通常不用碳酸钙粉末与稀盐酸反应制取![]() 的原因是 (8) ;若要制取并收集一瓶
的原因是 (8) ;若要制取并收集一瓶![]() ,且能使反应随关随停,选用的装置组合是 (9) (填字母);证明二氧化碳已收集满的方法是 (10) 。
,且能使反应随关随停,选用的装置组合是 (9) (填字母);证明二氧化碳已收集满的方法是 (10) 。
③实验室用双氧水和二氧化锰粉末制取氧气时;在二氧化锰的催化作用下,过氧化氢迅速分解生成氧气和水,反应的化学方程式为 (11) 。哪些因素还影响着过氧化氢分解的速率?甲小组探究了溶质质量分数对过氧化氢分解的速率有影响,乙小组进行了更深入的探究:温度是否影响着过氧化氢分解的速率呢?
实 验 步 骤 | 现 象 | 结 论 |
取一支试管,加入5mL5%的过氧化氢溶液,然后把试管放入盛有冷水的烧杯中; | 缓慢有少量 气泡冒出 | (13) |
另取一支试管,加入 (12) , 然后把试管放入盛有热水的烧杯中。 | 迅速有大量 气泡冒出 |
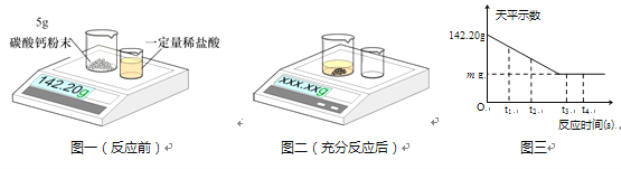
④丙小组用装置C制取氧气,试管中固体的质量随加热时间变化的数据见下表。反应结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g。
加热时间/min | 0 | t1 | t2 | t3 |
固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
(I)组装装置C时,下列仪器用品的组装顺序是 (14) (填序号)。
a.试管 b.铁架台 c.酒精灯 d.木块
(II)共制得氧气的物质的量为 (15) mol。
(III)所得氯化钾溶液的溶质质量分数(根据化学方程式列式计算) (16) 。