题目内容
(7分)某工业生产上规定空气中二氧化硫的允许排放量不得超过0.02mg/m3。某研究性学习小组利用“碘量法”测定某化工厂附近空气中的二氧化硫的含量,请你参与并协助他们完成相关学习任务。
【查阅资料】淀粉遇碘(I2)变蓝,遇氢碘酸(HI)不变色。氢碘酸为无色液体。
【测定原理】
碘溶液吸收SO2的化学反应原理是:SO2 + I2 + 2H2O==X + 2HI。X的化学式为 。
【测定步骤】
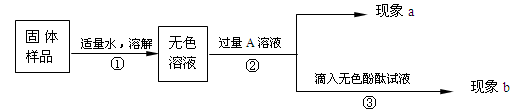
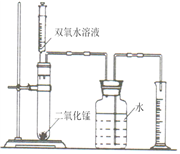
取配制好的碘(I2)溶液5.00mL(含I2的质量为6.35×10-4 mg)于下述装置中的反应容器内,并滴加2-3滴无色淀粉溶液。

利用上述装置到指定的测试点抽气,每拉动1次注射器抽气100mL,并注入碘溶液中,直到反应恰好完全为止,记录抽气的次数。抽气时应进行的操作是 。实验中表明恰好完全反应的现象
是
(3)换到不同地点再重复实验4次(每次所取碘溶液相同)。这样做的目的是 。
每次实验的抽气次数记录 见下表。
【得出结论】
【交流与讨论】
实验结束后,有同学提议:可将插入碘溶液的导管下端改成具有多孔的球泡,有利于提高实验的准确度,其理由是 。
【查阅资料】淀粉遇碘(I2)变蓝,遇氢碘酸(HI)不变色。氢碘酸为无色液体。
【测定原理】
碘溶液吸收SO2的化学反应原理是:SO2 + I2 + 2H2O==X + 2HI。X的化学式为 。
【测定步骤】
取配制好的碘(I2)溶液5.00mL(含I2的质量为6.35×10-4 mg)于下述装置中的反应容器内,并滴加2-3滴无色淀粉溶液。

利用上述装置到指定的测试点抽气,每拉动1次注射器抽气100mL,并注入碘溶液中,直到反应恰好完全为止,记录抽气的次数。抽气时应进行的操作是 。实验中表明恰好完全反应的现象
是
(3)换到不同地点再重复实验4次(每次所取碘溶液相同)。这样做的目的是 。
每次实验的抽气次数记录 见下表。
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 抽气次数 | 42 | 38 | 36 | 44 | 40 |
| 二氧化硫的含量 | 是否超标 |
| | |
实验结束后,有同学提议:可将插入碘溶液的导管下端改成具有多孔的球泡,有利于提高实验的准确度,其理由是 。
【测定原理】 H2SO4【测定步骤】(2)关闭k2打开k1,向外拉动注射器 溶液由蓝色恰好变成无色(3)多次测量,取平均值,使结果更准确
【得出结论】
【交流与讨论】
增大气体与液体的接触面积,使二氧化硫被充分吸收
【得出结论】
| 二氧化硫的含量 | 是否超标 |
| 0.04mg/m3 | 超标 |
增大气体与液体的接触面积,使二氧化硫被充分吸收
试题分析:【测定原理】根据质量守恒定律可知碘溶液吸收SO2的化学反应原理是:SO2 + I2 + 2H2O==X + 2HI。X的化学式为H2SO4【测定步骤】利用上述装置到指定的测试点抽气,每拉动1次注射器抽气100mL,并注入碘溶液中,直到反应恰好完全为止,记录抽气的次数。抽气时应进行的操作是关闭k2打开k1,向外拉动注射器。实验中表明恰好完全反应的现象是溶液由蓝色恰好变成无色;(3)换到不同地点再重复实验4次(每次所取碘溶液相同)。这样做的目的是)多次测量,取平均值,使结果更准确【得出结论】根据方程式进行计算可得
| 二氧化硫的含量 | 是否超标 |
| 0.04mg/m3 | 超标 |
实验结束后,有同学提议:可将插入碘溶液的导管下端改成具有多孔的球泡,有利于提高实验的准确度,其理由是增大气体与液体的接触面积,使二氧化硫被充分吸收

练习册系列答案
相关题目