题目内容
京京同学对金属活动性顺序等知识进行了研究.(1)根据图中的实验现象判断,稀盐酸里的A、B、C、D四种金属中,在金属活动性顺序里,位于氢后面的金属是(填字母)

(2)将甲、乙两种金属片分别放入硫酸铜溶液中,乙表面析出红色固体,申没有明显现象.判断甲、乙、铜三种金属的活动性由强到弱的顺序为
(3)查阅资料:金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原.在下列①②中各写一个化学方程式,③中写出还原金屑氧化物的方法.

(4)查阅资料:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
反应生成的NO是无色、难溶于水的气体,在常温下与空气中的O2迅速化合生成 N02,N02是红棕色、有刺激性气味的有毒气体.
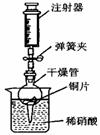
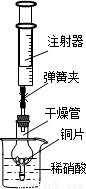
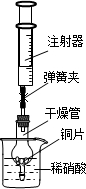
用如图所示实验装置进行实验,可以证明铜与稀硝酸反应生成的气体是NO.
①检查装置的气密性:关闭弹簧夹,将干燥管放入带有水的烧杯
中,若观察到
则表明该装置的气密性良好.
②按如图所示进行实验:打开弹簧夹,用注射器慢慢抽取干燥管内的气体,稀硝酸沿着干燥管慢慢上升,直到
停止抽拉注射器,关闭弹簧夹,观察干燥管内的现象:
反应停止后,打开弹簧夹,用注射器抽取千燥管内的气体(事先已将注射器内原有的气体推出),关闭弹簧夹后取下注射器,并抽取一定量的空气,观察到气体变为红棕色.
③上述实验完成后,用足量NaOH溶液将气体吸收,其目的是
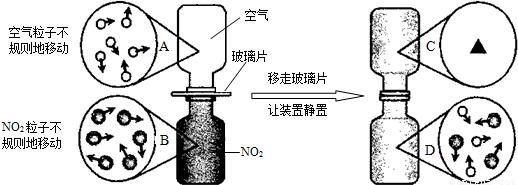
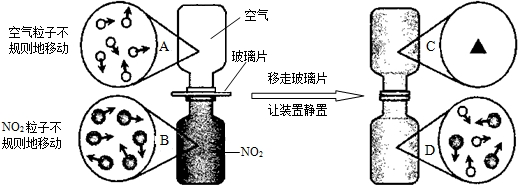
④如图是NO2气体和空气混合的实验示意图,观察图中A、B、D的表示方法,在C处 画出相应的气体组成的粒子示意图.
⑤在3.84g Cu中加入100g稀HNO3溶液,如恰好完全反应,计算生成NO的质量(化学方程式见上)和反应前稀HNO3溶液中溶质的质量分数. (请写出计算过程)
分析:(1)在金属活动性顺序里,位于氢后面的金属是不能与酸发生反应;
(2)分析题中信息可知:甲不能与硫酸铜反应,而乙能置换出铜;
(3)利用题中信息:金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原,选取合适的金属氧化物写出符合反应要求的化学方程式;
(4)①装置不漏气,干燥管放入溶液中溶液不能大量进入;
②使稀硝酸充满干燥管,以确保管内不残留有空气;铜片与稀硝酸发生反应,放出气体,溶液变成蓝色硫酸铜溶液;
③氮的氧化物都是有毒气体,应避免造成空气污染;
④移走玻璃片,气体分子不断运动,两瓶气体相互扩散;
⑤根据反应的化学方程式,由反应消耗铜的质量计算生成NO的质量和消耗硝酸的质量,再利用溶质的质量分数计算公式,求出反应前稀HNO3溶液中溶质的质量分数.
(2)分析题中信息可知:甲不能与硫酸铜反应,而乙能置换出铜;
(3)利用题中信息:金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原,选取合适的金属氧化物写出符合反应要求的化学方程式;
(4)①装置不漏气,干燥管放入溶液中溶液不能大量进入;
②使稀硝酸充满干燥管,以确保管内不残留有空气;铜片与稀硝酸发生反应,放出气体,溶液变成蓝色硫酸铜溶液;
③氮的氧化物都是有毒气体,应避免造成空气污染;
④移走玻璃片,气体分子不断运动,两瓶气体相互扩散;
⑤根据反应的化学方程式,由反应消耗铜的质量计算生成NO的质量和消耗硝酸的质量,再利用溶质的质量分数计算公式,求出反应前稀HNO3溶液中溶质的质量分数.
解答:解:(1)图中金属D表面无气泡产生,不能与酸发生反应;
故答案为:D;
(2)放入硫酸铜溶液中,乙表面析出红色固体,甲没有明显现象,说明甲的活动性不如铜强,而乙的活动性比铜强;
故答案为:乙>Cu>甲;
(3)①氧化汞受热分解生成汞和氧气;
故答案为:2HgO
2Hg+O2↑;
②单质碳在高温条件下可与氧化铜反应生成铜和二氧化碳;
故答案为:C+2CuO
2Cu+CO2↑;
③反应物铝为金属单质,反应后生成氧化铝;可看成金属铝还原氧化铁生成氧化铝和铁;则还原方法可概括为:用一种金属还原金属氧化物;
故答案为:用一种金属还原金属氧化物;
(4)①烧杯内液体不能较多进入干燥管,可说明装置气密性良好;即观察到:干燥管内的液面比烧杯内的液面低,且过一段时间后干燥管内的液面保持不变;
故答案为:若干燥管内的液(水)面比烧杯内的液(水)面低,且过一段时间后干燥管内的液(水)面保持不变;
②为排尽管内空气,应使稀硝酸充满干燥管;进入管内的稀硝酸与铜反应,放出气体,溶液逐渐变成蓝色,在气体不断产生时,管内液面下降;
故答案为:充满干燥管;铜片表面有气泡产生,铜片溶解,溶液由无色变成蓝色,液面下降;
③得用氢氧化钠吸收有毒的气体,防止造成空气污染;
故答案为:防止污染空气;
④由于气体分子不断运动,气体相互扩散而均匀混合,因此C、D两瓶内粒子基本相同,C瓶内粒子图应与D一致;
故答案为: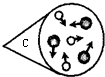 ;
;
⑤设生成NO的质量为x,稀硝酸中溶质的质量为y
3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O
192 504 60
3.84g y x
=
y=10.08g
=
x=1.2g
反应前稀HNO3溶液中溶质的质量分数=
×100%=10.08%
答:生成NO的质量为1.2g,反应前稀HNO3溶液中溶质的质量分数为10.08%.
故答案为:D;
(2)放入硫酸铜溶液中,乙表面析出红色固体,甲没有明显现象,说明甲的活动性不如铜强,而乙的活动性比铜强;
故答案为:乙>Cu>甲;
(3)①氧化汞受热分解生成汞和氧气;
故答案为:2HgO
| ||
②单质碳在高温条件下可与氧化铜反应生成铜和二氧化碳;
故答案为:C+2CuO
| ||
③反应物铝为金属单质,反应后生成氧化铝;可看成金属铝还原氧化铁生成氧化铝和铁;则还原方法可概括为:用一种金属还原金属氧化物;
故答案为:用一种金属还原金属氧化物;
(4)①烧杯内液体不能较多进入干燥管,可说明装置气密性良好;即观察到:干燥管内的液面比烧杯内的液面低,且过一段时间后干燥管内的液面保持不变;
故答案为:若干燥管内的液(水)面比烧杯内的液(水)面低,且过一段时间后干燥管内的液(水)面保持不变;
②为排尽管内空气,应使稀硝酸充满干燥管;进入管内的稀硝酸与铜反应,放出气体,溶液逐渐变成蓝色,在气体不断产生时,管内液面下降;
故答案为:充满干燥管;铜片表面有气泡产生,铜片溶解,溶液由无色变成蓝色,液面下降;
③得用氢氧化钠吸收有毒的气体,防止造成空气污染;
故答案为:防止污染空气;
④由于气体分子不断运动,气体相互扩散而均匀混合,因此C、D两瓶内粒子基本相同,C瓶内粒子图应与D一致;
故答案为:
 ;
;⑤设生成NO的质量为x,稀硝酸中溶质的质量为y
3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O
192 504 60
3.84g y x
| 192 |
| 3.84g |
| 504 |
| y |
| 192 |
| 3.84g |
| 60 |
| x |
反应前稀HNO3溶液中溶质的质量分数=
| 10.08g |
| 100g |
答:生成NO的质量为1.2g,反应前稀HNO3溶液中溶质的质量分数为10.08%.
点评:本题涉及知识繁杂,解答时应逐题单独分析,不可因出现在一道题中而误将不相关的内容混为一谈.

练习册系列答案
相关题目
 (京京同学对金属活动性顺序等知识进行了研究.
(京京同学对金属活动性顺序等知识进行了研究.