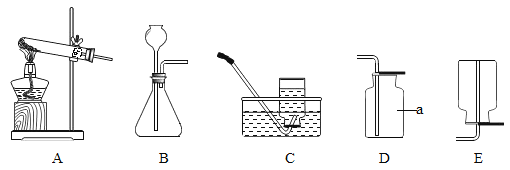
题目内容
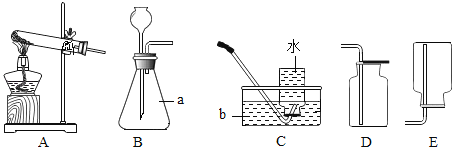
【题目】某同学设计的工业制备氢氧化钠的流程如下图。
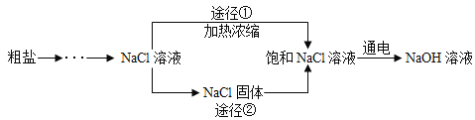
资料:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,两电极一端得到NaOH和H2,另一端得到Cl2。
2NaOH+H2↑+Cl2↑,两电极一端得到NaOH和H2,另一端得到Cl2。
(1)晾晒海水得到粗盐的原理是_____。
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、酒精灯、蒸发皿和_____。
(3)工业生产中应选择途径_____( “①”或“②”),理由是_____。
(4)Cl2可用于生产84消毒液(有效成分NaClO),反应原理为Cl2+2NaOH=NaClO+NaCl+H2O,反应前后氯元素的化合价有_____种。
(5)电解水的实验可测定水的组成,不能加入NaCl增强水的导电性的理由是_____。电解水的化学方程式为_____。
【答案】蒸发结晶 玻璃棒 ① 步骤简单 3 加氯化钠会生成氯气,干扰实验结果 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
【解析】
(1)晾晒海水得到粗盐的原理是蒸发结晶;
(2)蒸发时用到的主要仪器:酒精灯、铁架台、坩埚钳、玻璃棒和蒸发皿等。
(3)根据流程图可以看出,途径①的步骤简单,故工业生产中应选择途径①;
(4)单质中元素化合价为零,反应前后氯气中氯元素为0价,根据化合物中元素化合价代数和为零可知反应后氯化钠中氯元素的化合价为-1价,反应后次氯酸钠中氯元素的化合价为+1,故反应前后氯元素的化合价有3种。
(5)要测定水组成,不能加入NaCl增强水的导电性是因为加氯化钠会生成氯气,干扰实验结果。电解水的化学方程式为2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。

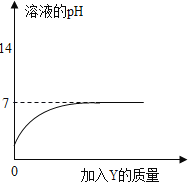
【题目】烧杯中盛有X溶液,逐滴加入Y物质,烧杯内液体的pH变化如图所示,则符合该变化的一组物质是( )
选项 | X | Y |
A | 稀HCl | NaOH溶液(过量) |
B | 稀H2SO4 | BaCl2溶液(少量) |
C | 稀HCl | CaCO3(过量) |
D | 稀H2SO4 | H2O |
A.AB.BC.CD.D