题目内容
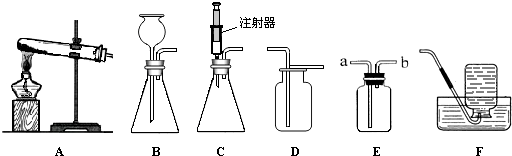
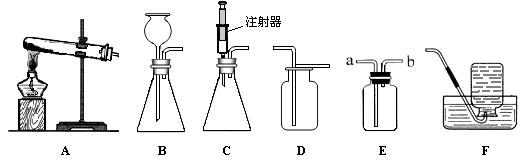
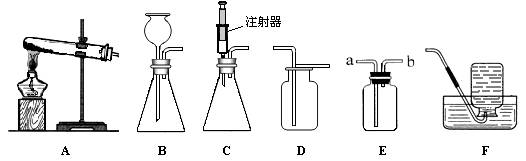
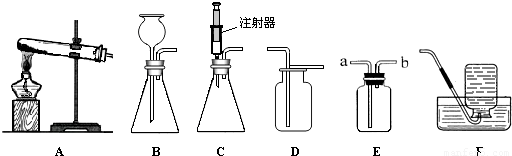
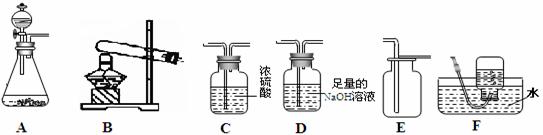
下图所示是实验室中制取气体时常用装置。请回答下列问题:
(1)在实验室中制取气体时,加入药品之前一定要先检验 。
(2)以石灰石和稀盐酸为原料制取并收集干燥的CO2气体。
①各装置的正确连接顺序是(填装置序号) 。
②产生CO2气体的化学方程式为 。
③C装置的作用是 。
④检验集气瓶中是不是CO2气体的方法
。
(3)同学甲为验证制取CO2后剩余溶液中是否含有盐酸(杂质不溶于水且不参加反应,且
CaCl2溶液呈中性),设计实验方案如下:取样于试管中,滴加AgNO3溶液,产 生白色沉淀,再加入稀硝酸,沉淀不溶解,则含有盐酸。你是否同意该方案?简述理由。
生白色沉淀,再加入稀硝酸,沉淀不溶解,则含有盐酸。你是否同意该方案?简述理由。
。
(4)将少量CO2气体通入盛有足量Ca(OH)2溶液的广口瓶中,瓶中溶液的质量与之前相比会 (填写下列各项序号)。
A.增大 B.减小 C.不变 D.无法判断
(1)装置的气密性;(2)①A、C、E;②CaCO3+2HCl=CaCl2+H2O+CO2↑。③干燥气体或吸收水蒸气或除去水蒸气;④加入少量的澄清石灰水并振荡。若看到澄清石灰水变浑浊,则是CO2。
(3)不同意。因为剩余溶液中一定含有CaCl2,不管是否含有稀盐酸,滴加AgNO3溶液都会产生不溶于稀硝酸的白色沉淀。
(4)B。