题目内容
在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应的条件”进行再探究.知识回放:通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
①一个中和反应______;
②一个有沉淀生成的反应______;
挖掘实质:
①下图是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推,硝酸钡在水中会解离出的离子是______
(填离子符号)
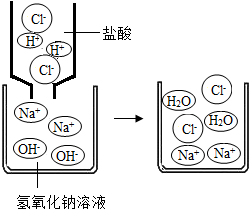
②下图是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质就是H+和OH-结合生成了难电离的水,而使溶液中H+和OH-的离子浓度迅速减小.表示为:H++OH-=H2O我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质:______.
实践应用:
通过上述探究发现,在溶液中H+和OH- 不能大量共存,我还发现在溶液中______和______(填离子符号)也不能大量共存.
知识升华:
对“复分解反应发生的条件”的再探究,我发现复分解反应条件的实质是______.

【答案】分析:【知识回放】
①根据中和反应的定义进行分析,
②根据四种物质中的离子生成的沉淀有硫酸钡和碳酸钡进行分析.
【挖掘实质】
①根据HCl在水中会解离出H+和Cl-,利用类比的思想分析硝酸钡离解出的离子;
②根据中和反应的实质就是氢离子和氢氧根离子中和反应,推导出有气体的反应;
【实践应用】根据发生复分解反应条件是离子之间生成水、沉淀、气体的反应来分析;
【知识升华】从反应前后离子浓度变化来分析.
解答:解:【知识回放】
(1)①酸和见生成盐和水的反应就是中和反应,四种物质中只有硫酸是酸,氢氧化钠是碱,化学方程式为:
①H2SO4+2NaOH=Na2SO4+2H2O
②四种物质之间会生成的沉淀只有碳酸钡沉淀和硫酸钡沉淀,所以化学方程式为:H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
【挖掘实质】
①HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是Ba2+和NO3-;②根据是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O;用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应2HCl+Na2CO3═2NaCl+H2O+CO2↑,该反应的实质:
2H++CO32-═H2O+CO2↑
【实践应用】通过上述探究发现,在溶液中H+和OH-不能大量共存,在溶液中Ba2+和SO42-也不能大量共存;
【知识升华】盐酸与氢氧化钠发生了复分解反应,反应后H+和OH-的浓度减少,发生复分解反应的实质是:溶液中离子浓度减少.
故答案为:
【知识回放】
①H2SO4+2NaOH═Na2SO4+2H2O;
②H2SO4+Ba(NO3)2═BaSO4↓+2HNO3 或 K2CO3+Ba(NO3)2═BaCO3↓+KNO3;
【挖掘实质】
①Ba2+ NO3-;
②2H++CO32-═H2O+CO2↑;
【实践应用】
Ba2+和 SO42-或 Ba2+和CO32-或 H+和 CO32-;
【知识升华】
溶液中离子浓度减小.
点评:在解该题时,首先要理解透复分解反应的条件是生成气体、水或沉淀,然后就是整合题中有用的知识采用类比的思想解答.
①根据中和反应的定义进行分析,
②根据四种物质中的离子生成的沉淀有硫酸钡和碳酸钡进行分析.
【挖掘实质】
①根据HCl在水中会解离出H+和Cl-,利用类比的思想分析硝酸钡离解出的离子;
②根据中和反应的实质就是氢离子和氢氧根离子中和反应,推导出有气体的反应;
【实践应用】根据发生复分解反应条件是离子之间生成水、沉淀、气体的反应来分析;
【知识升华】从反应前后离子浓度变化来分析.
解答:解:【知识回放】
(1)①酸和见生成盐和水的反应就是中和反应,四种物质中只有硫酸是酸,氢氧化钠是碱,化学方程式为:
①H2SO4+2NaOH=Na2SO4+2H2O
②四种物质之间会生成的沉淀只有碳酸钡沉淀和硫酸钡沉淀,所以化学方程式为:H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
【挖掘实质】
①HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是Ba2+和NO3-;②根据是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O;用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应2HCl+Na2CO3═2NaCl+H2O+CO2↑,该反应的实质:
2H++CO32-═H2O+CO2↑
【实践应用】通过上述探究发现,在溶液中H+和OH-不能大量共存,在溶液中Ba2+和SO42-也不能大量共存;
【知识升华】盐酸与氢氧化钠发生了复分解反应,反应后H+和OH-的浓度减少,发生复分解反应的实质是:溶液中离子浓度减少.
故答案为:
【知识回放】
①H2SO4+2NaOH═Na2SO4+2H2O;
②H2SO4+Ba(NO3)2═BaSO4↓+2HNO3 或 K2CO3+Ba(NO3)2═BaCO3↓+KNO3;
【挖掘实质】
①Ba2+ NO3-;
②2H++CO32-═H2O+CO2↑;
【实践应用】
Ba2+和 SO42-或 Ba2+和CO32-或 H+和 CO32-;
【知识升华】
溶液中离子浓度减小.
点评:在解该题时,首先要理解透复分解反应的条件是生成气体、水或沉淀,然后就是整合题中有用的知识采用类比的思想解答.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目

 36、在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
36、在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
 在高效复习课堂中,同学们利用“硝酸、氯化钡、氢氧化钾、硫酸镁”四种物质的溶液对“复分解反应发生的条件”进行再探究.
在高效复习课堂中,同学们利用“硝酸、氯化钡、氢氧化钾、硫酸镁”四种物质的溶液对“复分解反应发生的条件”进行再探究.