题目内容
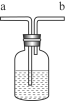
【题目】某同学进行下列图示实验,探究碳酸钾的某些化学性质。
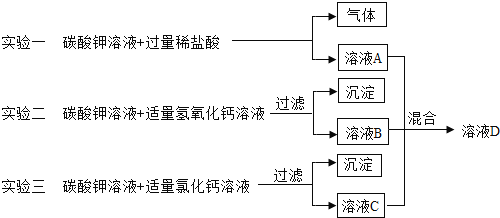
(1)实验一中的现象为_____;
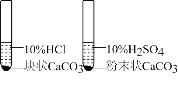
(2)写出实验二中发生反应的化学方程式_____;
(3)下列试剂组合中,能够判断溶液 D 中溶质成分的是_____。
A 酚酞溶液和Na2CO3 溶液 B Mg 和 CuSO4 溶液
C Fe2O3 和 CO2 D NH4Cl 溶液和 Cu(OH)2
【答案】有气泡产生 K2CO3+Ca(OH)2═CaCO3↓+2KOH ABD
【解析】
(1)碳酸钾能够和盐酸反应产生二氧化碳,因此观察到有气泡产生;
(2)碳酸钾和氢氧化钙反应产生碳酸钙沉淀和氢氧化钾,反应的方程式为:K2CO3+Ca(OH)2═CaCO3↓+2KOH;
(3)碳酸钾分别与盐酸、氢氧化钙、氯化钙反应产生的溶质有、氯化氢、氯化钾和氢氧化钾,混合过程中,盐酸、氢氧化钾反应生成氯化钾和水,至于氯化钾题目设计没打算检验,所以就是检验在最后混合后得到的溶液中到底是盐酸剩余还是氢氧化钾剩余.结合这些物质的性质分析如下:
A、向溶液D中滴加酚酞试液,若酚酞试液变成红色,说明溶液显碱性,说明没有盐酸的剩余,剩余了氢氧化钾;若加入酚酞不变色,则再滴加碳酸钠溶液,滴加碳酸钠溶液有气泡产生,则有盐酸剩余,故正确;
B、向溶液D中加入金属镁,观察有气泡产生,则判断盐酸剩余;若加入镁无明显变化,再滴加硫酸铜溶液观察有无蓝色沉淀产生,判断氢氧化钾钙是否剩余,故正确;
C、向溶液D中加入氧化铁,若溶液变成黄色,则有盐酸,则一定没有氢氧化钾;若溶液没有变成黄色,则没有盐酸,通入二氧化碳,氢氧化钾即使有剩余也不会有明显的变浑浊,无法确定氢氧化钾是否剩余,故错误;
D、向溶液D中加入氢氧化铜,看能否溶解,确定是否含有盐酸;若氢氧化铜无明显变化,再滴加氯化铵是否产生刺激性气味的气体,可以确定是否含有氢氧化钾,故正确。

 名校课堂系列答案
名校课堂系列答案【题目】“84”消毒液在新冠肺炎预防措施中使用较为广泛,其还具有漂白、杀菌、消毒的功效。某化学兴趣小组对 一瓶敞口久置的“84”消毒液的成分产生兴趣,在老师的指导下,展开探究。
已知:“84”消毒液和洁厕灵作用会产生氯气。
(提出问题)该敞口久置的消毒液中溶质有哪些?
(查阅资料)“84”消毒液的主要成分是次氯酸钠(NaClO)和氯化钠;NaClO 为有效成分,有腐蚀性并 易与空气中的 CO2 反应(2NaClO+CO2+H2O==2HClO+Na2CO3)。NaClO溶液、HClO都具有漂白、杀菌、消毒功效。HClO 不稳定,受热或光照条件下会发生分解。
(分析讨论)小组同学经过讨论,认为该消毒液中的溶质一定有____________________,可能还有 NaClO、Na2CO3、HClO中的一种或多种。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
Ⅰ.向装入红色布条的试管中加入适量该消毒液 | 布条长时间不褪色 | 消毒液中不含___________ |
Ⅱ.另取少量该消毒液于试管中,滴入氯化钡溶液 | 白色沉淀 | 消毒液中含__________,发生反应的化学方程式为 ________ 。 |
(交流反思)生活中,“84”消毒液贮藏时应注意________________;一般不用“84”消毒液对蔬菜、水果进行消毒,其原因可能是________________。
(拓展延伸)
(1)次氯酸钠与稀硫酸可发生复分解反应,化学方程式为 __________________。
(2)“84”消毒液______(“能”或“不能”)与洁厕灵混合使用。