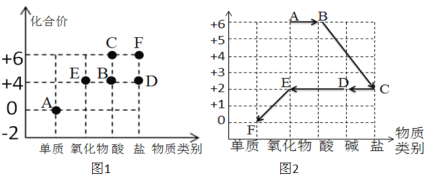
��Ŀ����
����Ŀ������п��Һ������ľ�ķ���������ҵ�ϳ��ú�п����Ҫ��ZnO����ϡ����Ϊԭ����ȡ����п����Ӧ�Ļ�ѧ����ʽΪ��H2SO4+ZnO=ZnSO4+H2O���㣺
��1������п����Ԫ�غ���Ԫ�ص�������Ϊ_____ ����п����Ԫ�ص���������______ ���������0.1%����
��2����Ҫ����10%������п��Һ300g����Ҫ����п______ g��ˮ________mL��
��3���ú�����п810kg�ĺ�п��������ϡ�����ַ�Ӧ�������п���е����ʲ���ϡ���ᷴӦ�����õ�������п�������Ƕ���?___________
���𰸡�32��64����1��2�� 19.9% 30 270 1610kg
��������
��1������п����Ԫ�غ���Ԫ�ص�������Ϊ��32����16��4��=32��64=1��2������п����Ԫ�ص���������Ϊ![]() ��100%��19.9%�����32��64����1��2�� 19.9%��
��100%��19.9%�����32��64����1��2�� 19.9%��
��2����Ҫ����10%������п��Һ300g����Ҫ����п����Ϊ:300g��10%=30g��ˮ������Ϊ��300g-30g=270g������ˮ���ܶ���1g/mL��������ˮ270mL�����30 270��
(3)�⣺��õ�������п������Ϊx��
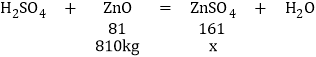
![]() ��x=1610kg
��x=1610kg
�𣺵õ�����п��������1610kg��

����Ŀ������ͼ���г��������ԣ���ij��ȤС������ʦָ���£�̽������ˮ�����ķ�Ӧ����ش�
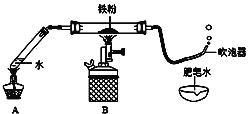
��ʵ���̽��
��1������װ�ã���___________��
��2��װ��ҩƷ��
��3������һ��ʱ������������������ݣ����������Ϸ�����ȼ�ŵ�ľ���������ݣ��ܲ���������
������ȼ�յĻ�ѧ����ʽΪ________��
���������ϡ��������������FeO��Fe2O3��Fe3O4����
�����Ƕ�������ˮ���������ۡ�Fe3O4�ܱ�������������FeO�Ӵ��������������ɺ�ɫ��Ϊ����ɫ�������������ﶼ��������ͭ��Һ��Ӧ���������ᷴӦ���ɿ��������ʡ�
��ʵ��̽����ʵ��С��ͬѧ�Է�Ӧ���ʣ��������̽����
��1��С÷���ֹ���Ϊ��ɫ���ɴ��ж�:�����п϶�������Fe2O3 ,������_______��
��2��С��ֹ�����ܱ�������������ҵ����������к�ɫ���壬ƽ���ڰ�ֽ�ϡ��۲�������__________���жϺ�ɫ������һ��û��FeO��
���ۣ�����ˮ������Ӧ���ɵĹ����ǡ�����һ����������������ڵĺ�ɫ�����л����ܺ��С�������������
��������롿�������к�ɫ����ɷ���ʲô?
�����Fe�� �����Fe3O4�� �����______________
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ���������������������� _________________ | ���ֺ�ɫ���壬���к�ɫ������� | ��ɫ������һ������ ________________ |
�����۷�˼����1������ˮ���������û���Ӧ����Ӧ�ķ���ʽ��________________��
��2�����ֺ�ɫ����Ļ�ѧ����ʽ��_______���������Һ����������ԭ����______________��