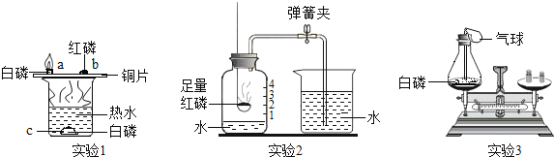
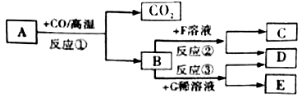
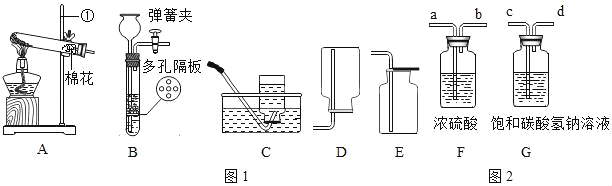
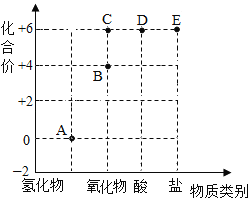
题目内容
【题目】化学小组同学在实验室用高温煅烧碳酸钙模拟工业制取二氧化碳。
(1)根据化学方程式计算:若50g碳酸钙全部分解,可制得多少克二氧化碳_______?
(2)小组同学测得50g碳酸钙煅烧后,剩余固体中钙元素与碳元素的质量比为50:3,则已分解的碳酸钙占原碳酸钙的质量分数为多少_________?
【答案】22g 80%
【解析】
(1)根据化学方程式进行计算,解:设制得的二氧化碳质量为x,
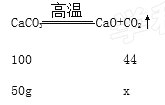
![]() 解得x=22g,答:可制得二氧化碳的质量为22g,故填22g;
解得x=22g,答:可制得二氧化碳的质量为22g,故填22g;
(2)由于碳酸钙高温分解生成了氧化钙和二氧化碳气体,固体中碳元素的含量逐渐减少直到为零,但是固体中钙元素质量不变,解设剩余碳酸钙的质量为x,50g碳酸钙中的钙元素质量=50g×![]() =20g,剩余碳酸钙中的碳元素质量=
=20g,剩余碳酸钙中的碳元素质量=![]() ,由题意知二者的比值为50∶3,即(50g×
,由题意知二者的比值为50∶3,即(50g×![]() )∶
)∶![]() =50∶3,解得x=10g,已分解的碳酸钙质量=50g-10g=40g,已分解的碳酸钙占原碳酸钙的质量分数为=
=50∶3,解得x=10g,已分解的碳酸钙质量=50g-10g=40g,已分解的碳酸钙占原碳酸钙的质量分数为=![]() ×100%=80%,答:已分解的碳酸钙占原碳酸钙的质量分数为80%,故填80%。
×100%=80%,答:已分解的碳酸钙占原碳酸钙的质量分数为80%,故填80%。

练习册系列答案
相关题目