题目内容
在实验室用一氧化碳还原2.0g赤铁矿样品,反应后生成的二氧化碳跟足量的澄清石灰水反应,生成了3.0g白色沉淀.求赤铁矿样品中Fe2O3的质量分数.
解:设生成3.0g碳酸钙需要二氧化碳的质量为x
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
x 3.0g
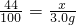 x=
x= =1.32g
=1.32g
设生成1.32g二氧化碳需要Fe2O3的质量为y
Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
160 132
y 1.32g
 =
= y=
y= =1.6g
=1.6g
赤铁矿样品中Fe2O3的质量分数为: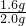 ×100%=80%
×100%=80%
答:赤铁矿样品中Fe2O3的质量分数为80%.
分析:本题涉及两个化学反应方程式:Fe2O3+3CO 2Fe+3CO2 和 CO2+Ca(OH)2═CaCO3↓+H2O,二者之间可通过二氧化碳相联系,根据后一个方程式3.0g白色沉淀,即生成3.0g碳酸钙的质量可以求出二氧化碳的质量,再根据二氧化碳的质量,利用前一个方程式可求出氧化铁的质量,进一步可求出样品中Fe2O3的质量分数.
2Fe+3CO2 和 CO2+Ca(OH)2═CaCO3↓+H2O,二者之间可通过二氧化碳相联系,根据后一个方程式3.0g白色沉淀,即生成3.0g碳酸钙的质量可以求出二氧化碳的质量,再根据二氧化碳的质量,利用前一个方程式可求出氧化铁的质量,进一步可求出样品中Fe2O3的质量分数.
点评:本题考查有关化学反应方程式的计算,在计算时一定要找准相关量之间的对应关系.
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
x 3.0g
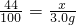 x=
x= =1.32g
=1.32g设生成1.32g二氧化碳需要Fe2O3的质量为y
Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2160 132
y 1.32g
 =
= y=
y= =1.6g
=1.6g赤铁矿样品中Fe2O3的质量分数为:
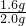 ×100%=80%
×100%=80%答:赤铁矿样品中Fe2O3的质量分数为80%.
分析:本题涉及两个化学反应方程式:Fe2O3+3CO
 2Fe+3CO2 和 CO2+Ca(OH)2═CaCO3↓+H2O,二者之间可通过二氧化碳相联系,根据后一个方程式3.0g白色沉淀,即生成3.0g碳酸钙的质量可以求出二氧化碳的质量,再根据二氧化碳的质量,利用前一个方程式可求出氧化铁的质量,进一步可求出样品中Fe2O3的质量分数.
2Fe+3CO2 和 CO2+Ca(OH)2═CaCO3↓+H2O,二者之间可通过二氧化碳相联系,根据后一个方程式3.0g白色沉淀,即生成3.0g碳酸钙的质量可以求出二氧化碳的质量,再根据二氧化碳的质量,利用前一个方程式可求出氧化铁的质量,进一步可求出样品中Fe2O3的质量分数.点评:本题考查有关化学反应方程式的计算,在计算时一定要找准相关量之间的对应关系.

练习册系列答案
相关题目

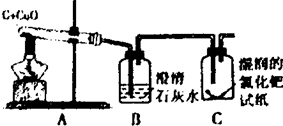 李洋同学在实验室用木炭和氧化铜两种黑色粉末在高温下反应制取单质铜,反应的化学方程式为:C+2CuO
李洋同学在实验室用木炭和氧化铜两种黑色粉末在高温下反应制取单质铜,反应的化学方程式为:C+2CuO