题目内容
化学是一门以实验为基础的科学,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合下列实验装置图回答问题:
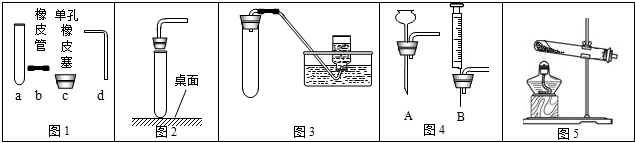
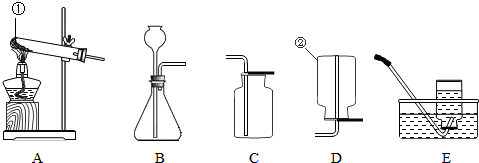
(1)请写出实验室利用图1中BD装置制取气体的化学方程式
(2)化学实验的绿色化就是以绿色化学的理念和原则来指导实验工作.从实现原料和反应过程的绿色化考虑,你认为在中学化学实验室中,如图2中甲、乙、丙、三种制取氧气的途径 中,
(3)实验室用氯化钠固体和浓硫酸发生复分解反应制取氯化氢气体,已知氯化氢气体易溶于水,则可选用的发生和收集装置分别是
(4)汽车尾气中含有一氧化氮和一氧化碳,它们均是大气污染物.一氧化氮是一种无色气体,难溶于水,密度与空气相差不大,在空气中能与氧气迅速反应生成红棕色的二氧化氮气体.实验室中制取一氧化氮采用的收集装置是(填序号)
(5)小红同学要在实验室用如图3制取干燥的二氧化碳,则D瓶内应盛装
(6)小明同学用如图3测定大理石的含量,方法是把10克大理石放入烧瓶内,逐渐加入稀盐酸,

(1)请写出实验室利用图1中BD装置制取气体的化学方程式
Zn+H2SO4=ZnSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
.(2)化学实验的绿色化就是以绿色化学的理念和原则来指导实验工作.从实现原料和反应过程的绿色化考虑,你认为在中学化学实验室中,如图2中甲、乙、丙、三种制取氧气的途径 中,
甲
甲
(填“甲”或“乙”或“丙”或“丁”)途径更体现化学实验的绿色化追求.绿色化学要求反应物的所有原子尽可能转化到产品中,则符合绿色化学的基本反应类型是化合反应
化合反应
.
(3)实验室用氯化钠固体和浓硫酸发生复分解反应制取氯化氢气体,已知氯化氢气体易溶于水,则可选用的发生和收集装置分别是
B、C
B、C
(填字母代号).若用氯化钠溶液和稀硫酸来制取氯化氢气体不
不
(是否)可行?原因是氯化钠溶液和稀硫酸不反应,稀硫酸没有氧化性
氯化钠溶液和稀硫酸不反应,稀硫酸没有氧化性
.(4)汽车尾气中含有一氧化氮和一氧化碳,它们均是大气污染物.一氧化氮是一种无色气体,难溶于水,密度与空气相差不大,在空气中能与氧气迅速反应生成红棕色的二氧化氮气体.实验室中制取一氧化氮采用的收集装置是(填序号)
E
E
.一氧化氮和一氧化碳在催化剂的作用下会生成两种参与大气循环的气体,请写出此反应的化学方程式2NO+2CO
N2+2CO2
| ||
2NO+2CO
N2+2CO2
.
| ||
(5)小红同学要在实验室用如图3制取干燥的二氧化碳,则D瓶内应盛装
浓硫酸
浓硫酸
溶液;若要测量生成二氧化碳的体积,可在E瓶内装水并滴少许植物,这样做的目的是防止二氧化碳气体溶于水
防止二氧化碳气体溶于水
,同时还需量筒
量筒
仪器.(6)小明同学用如图3测定大理石的含量,方法是把10克大理石放入烧瓶内,逐渐加入稀盐酸,
气泡不再冒出的
气泡不再冒出的
现象时不需再加入盐酸;,若E瓶内的烧碱溶液增重3.3克,请计算此大理石的含量.分析:实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集;用过氧化氢制氧气不需要加热,生成物环保,更体现化学实验的绿色化追求;绿色化学要求反应物的所有原子尽可能转化到产品中,则符合绿色化学的基本反应类型是化合反应.实验室用氯化钠固体和浓硫酸发生复分解反应制取氯化氢气体,因此不需要加热,已知氯化氢气体易溶于水密度比空气大,因此只能用向上排空气法收集;不能用氯化钠溶液和稀硫酸来制取氯化氢气体,因为氯化钠溶液和稀硫酸不反应,稀硫酸没有氧化性.一氧化氮是一种无色气体,难溶于水,密度与空气相差不大,因此一氧化氮只能用排水法收集;一氧化氮和一氧化碳在催化剂的作用下会生成氮气和二氧化碳,配平即可.浓硫酸可以干燥二氧化碳气体,若要测量生成二氧化碳的体积,可在E瓶内装水并滴少许植物,这样做的目的是防止二氧化碳气体溶于水,要量取体积,还需要量筒.当气泡不再冒出时,证明二氧化碳气体不再产生,有关的计算要准确.
解答:解:(1)实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集; 锌和硫酸反应生成硫酸锌和氢气,故答案为:Zn+H2SO4=ZnSO4+H2↑;
(2)用过氧化氢制氧气不需要加热,生成物环保,更体现化学实验的绿色化追求;绿色化学要求反应物的所有原子尽可能转化到产品中,则符合绿色化学的基本反应类型是化合反应;故答案为:甲;化合反应
(3)实验室用氯化钠固体和浓硫酸发生复分解反应制取氯化氢气体,因此不需要加热,已知氯化氢气体易溶于水密度比空气大,因此只能用向上排空气法收集;不能用氯化钠溶液和稀硫酸来制取氯化氢气体,因为氯化钠溶液和稀硫酸不反应,稀硫酸没有氧化性;故答案为:B、C;不;氯化钠溶液和稀硫酸不反应,稀硫酸没有氧化性
(4)一氧化氮是一种无色气体,难溶于水,密度与空气相差不大,因此一氧化氮只能用排水法收集;一氧化氮和一氧化碳在催化剂的作用下会生成氮气和二氧化碳,配平即可;故答案为:E;2NO+2CO
N2+2CO2
(5)浓硫酸可以干燥二氧化碳气体,若要测量生成二氧化碳的体积,可在E瓶内装水并滴少许植物,这样做的目的是防止二氧化碳气体溶于水,要量取体积,还需要量筒,故答案为:浓硫酸;防止二氧化碳气体溶于水;量筒
(6)设碳酸钙的质量分数为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
10x 3.3g
=
x=75%
故答案为:气泡不再冒出的;75%
(2)用过氧化氢制氧气不需要加热,生成物环保,更体现化学实验的绿色化追求;绿色化学要求反应物的所有原子尽可能转化到产品中,则符合绿色化学的基本反应类型是化合反应;故答案为:甲;化合反应
(3)实验室用氯化钠固体和浓硫酸发生复分解反应制取氯化氢气体,因此不需要加热,已知氯化氢气体易溶于水密度比空气大,因此只能用向上排空气法收集;不能用氯化钠溶液和稀硫酸来制取氯化氢气体,因为氯化钠溶液和稀硫酸不反应,稀硫酸没有氧化性;故答案为:B、C;不;氯化钠溶液和稀硫酸不反应,稀硫酸没有氧化性
(4)一氧化氮是一种无色气体,难溶于水,密度与空气相差不大,因此一氧化氮只能用排水法收集;一氧化氮和一氧化碳在催化剂的作用下会生成氮气和二氧化碳,配平即可;故答案为:E;2NO+2CO
| ||
(5)浓硫酸可以干燥二氧化碳气体,若要测量生成二氧化碳的体积,可在E瓶内装水并滴少许植物,这样做的目的是防止二氧化碳气体溶于水,要量取体积,还需要量筒,故答案为:浓硫酸;防止二氧化碳气体溶于水;量筒
(6)设碳酸钙的质量分数为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
10x 3.3g
| 100 |
| 10gx |
| 44 |
| 3.3g |
x=75%
故答案为:气泡不再冒出的;75%
点评:本考点主要考查了绿色化学、气体的制取装置和收集装置的选择,同时也考查了气体的干燥、化学方程式的书写和有关的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 20、化学是一门以实验为基础的科学,规范的实验操作是实验成功的前提,请回答:
20、化学是一门以实验为基础的科学,规范的实验操作是实验成功的前提,请回答: