题目内容
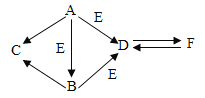
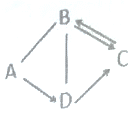
【题目】A、B、C、D中都含有地壳中含量最多的元素,它们之间的关系如图所示,一表示物质间可以相互反应,→表示一种物质可以转化成另一种物质。B可用于光合作用,A→D放热反应。
(1)B在生活中的用途是______。
(2)C的化学式为________。
(3)A→D反应的化学方程式是_______,基本反应类型是______
【答案】灭火等 CaCO3 CaO+ H2O= Ca(OH)2 化合反应
【解析】
A、B、C、D中都含有地壳中含量最多的元素,所以四种物质中都含有氧元素,B可用于光合作用,B为二氧化碳;A→D放热反应,氧化钙和水反应生成氢氧化钙,反应放热,所以A为氧化钙或水,D为氢氧化钙;A能与二氧化碳,所以A为水;二氧化碳和氢氧化钙反应生成碳酸钙,碳酸钙和盐酸反应或碳酸钙高温下分解都生成二氧化碳,所以C为碳酸钙,带入检验,合理。
(1)二氧化碳在生活中的用途是灭火(或其它合理答案);
(2)碳酸钙的化学式为CaCO3;
(3)氧化钙和水反应生成氢氧化钙的化学方程式是:CaO+ H2O= Ca(OH)2,基本反应类型是由两种物质生成一种物质的化合反应。

【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:
(1)样品中碳酸钙的质量为_____g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数_______。(写出计算过程,最终结果保留0.1%)。
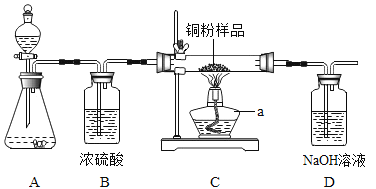
【题目】如下图所示,某校化学兴趣小组用过氧化氢(H2O2)溶液(MnO2作催化剂) 制取干燥氧气,并用来测定 10g 某铜粉样品(含少量杂质碳)中铜的质量分数。
回答下列问题:(温馨提示:2Cu+O2![]() 2CuO;氢氧化钠溶液可以吸收二氧化碳)
2CuO;氢氧化钠溶液可以吸收二氧化碳)
(实验一)
(1)装置A 中发生的化学方程式是__________。装置B的作用是__________。
(2)通过称量完全反应前后装置__________的质量,进行计算便可求出样品中铜的质量分数。
(3)实验完毕,小华同学误将用剩的H2O2溶液和装置C玻璃管中的剩余固体一起倒入烧杯中,发同有大量的气泡产生,经检验确认产生的气体是氧气,小江和小田两位同学对此颇感兴趣,进而展开了他们的探究之旅。
(提出问题)
是哪种物质加快了H2O2的分解速率?
(大胆猜想)
猜想①:剩余固体中的氧化铜加快了H2O2溶液的分解。
猜想②:氧化铜能做H2O2分解的催化剂。
(实验二)
实验方案 | 实验现象 | 分析及结论 |
步骤一:将带火星的木条伸入盛有5mL5%过氧化氢溶液的试管。 | 带火星木条不复燃 | H2O2溶液常温下产生氧气的量很少,不足以使带火星复燃。 |
步骤二:向盛有 5mL5%H2O2溶液的试管中加入 1g 氧化铜固体,将一根带火星的木条伸入试管中。观察现象。待反应结束后将试管里的剩余物进行___________、洗涤、干燥、称量。对比反应前后固体的质量。 | 称得固体质量为 1g | 猜想①成立,并且反应前后固体的质量相等。 |
(讨论交流)
小川同学认为,根据步骤一、二的实验现象,得出的两个结论就能判断猜想②成立。你是否支持他的观点?___________。若要证明猜想②成立,你认为还应补做的实验是___________。
(4)该化学兴趣小组利用压强传感器,对MnO2、CuO、Fe2O3三种金属氧化物中,哪一个更适宜作过氧化氢制取氧气的催化剂,又做了如下数字化实验探究。
(实验三)实验方法如下:
Ⅰ.用MnO2、CuO、Fe2O3三种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
Ⅱ.取30粒含MnO2的海藻酸钠微球,采用如下图所示装置进行实验。改用其他两种微球,分别重复上述实验,得到的锥形瓶内压强随时间变化的曲线如下图所示。
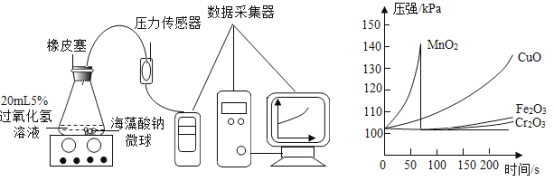
①每次重复实验时,海藻酸钠微球数应相同的原因是_________________________________。
②用含MnO2的海藻酸钠微球进行实验,60s 时压强瞬间回落,其原因可能是____________________。
③从实验曲线看,催化效果较好,反应温和的催化剂是______________________。