题目内容
【题目】我们的日常生活离不开金属. 
(1)如图甲是金属的一个应用实例,请说出利用了金属的什么物理性质?(答出一点即可) .
(2)据有关资料报导,现在世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%﹣40%.铁生锈是铁与空气中的水蒸气、等发生化学反应的过程.
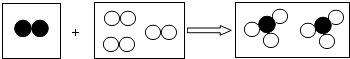
(3)在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如图乙三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
①一段时间后,可观察到实验Ⅱ的现象是;反应的化学方程式是
②小组中的甲同学认为:通过实验Ⅰ和Ⅲ可比较出锌和铁的金属活动性强弱.你认为他依据的实验现象是 .
③乙和丙两位同学认为上述三个实验不能够得出四种金属的活动性顺序,原因是
并在上述实验的基础上,补充了一个实验(如图丙所示),实现了探究目的.他们的实验:X是金属 , Y是溶液(写出化学式).
【答案】
(1)导电性;延展性
(2)氧气
(3)铜片表面有银白色固体附着;Cu+2AgNO3═Cu(NO3)2+2Ag;实验Ⅲ中产生气体的速度比实验Ⅰ的快;无法比较Fe和Cu的活动性;Fe;CuSO4
【解析】解:(1)金属可以制作电线说明金属具有良好的导电性、延展性;(2)根据铁生锈的条件是,铁在与氧气和水同时接触时容易生成铁锈;(3)①实验Ⅱ中,铜的活动性比银强,能够从硝酸银溶液中置换出银,红色铜片表面有银白色固体析出,无色溶液变蓝色,其反应化学方程式为:Cu+2AgNO3═Cu( NO3)2+2Ag;②Ⅰ中铁和稀盐酸能够反应,Ⅲ中锌片也能够和稀盐酸反应,这两个同时都反应,它们的形状与大小及稀盐酸的质量分数和用量均相同的条件下,实验Ⅲ中产生气体的速度比实验Ⅰ的快,锌比铁反应剧烈,这说明了锌比铁更活泼;③实验Ⅰ和实验Ⅲ能证明锌比铁活动性强,实验Ⅰ实验Ⅱ无法比较Fe和Cu的活动性;在补充实验中,可用铁置换硫酸铜中的铜,可以证明铁比铜活泼,故可判断出该三种金属的活动性由强到弱的顺序为锌、铁、铜,它们的活动性都比银强;所以答案是:(1)导电性、延展性;(2)氧气;(3)①铜片表面有银白色固体附着;Cu+2AgNO3═Cu(NO3)2+2Ag;②实验Ⅲ中产生气体的速度比实验Ⅰ的快;③无法比较Fe和Cu的活动性;Fe;CuSO4 .
【考点精析】根据题目的已知条件,利用金属的物理性质及用途的相关知识可以得到问题的答案,需要掌握金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽.(2)大多数呈银白色(铜为紫红色,金为黄色)(3)有良好的导热性、导电性、延展性.

【题目】科学实验测定,正常情况下人类头发的化学组成为:45%的碳,28%的氧,15%的氮,7%的氢和5%的硫等,则灼烧头发不可能生成的物质是( )
A. 水 B. 二氧化碳 C. 氯化氢 D. 二氧化硫
【题目】下表是元素周期表的一部分
周期 | 族 | |||||||
IA |
| 0 | ||||||
一 | 1 H | ⅡA | ⅢA | ⅣA | V A | ⅥA | ⅦA | 2 He |
二 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne |
三 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar |
(1)12号元素的元素名称为;Be元素的相对原子质量为 .
(2)相对原子质量为28.09的元素属元素(填“金属”或“非金属”);Ne的化学性质;O 与S元素化学性质相似的原因为 .
(3)表中不同种元素最本质的区别是(填字母).
A.质子数不同
B.相对原子质量不同
C.中子数不同
(4)如图为某元素的原子结构示意图,该元素位于周期表中第周期. 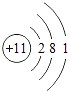
(5)从11Na﹣18Ar你可总结出的一条规律是 .