��Ŀ����
����Ŀ��ij��ѧ��ȤС���������ͼʾ����ģ����ͭ��ʵ�飬���Բ���ɷֽ���̽���� 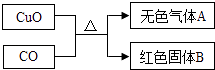
��������⡿
��ɫ����A����Щ�ɷ֣���ɫ����B������ʲô��
����������衿
��1������Ϊ��ɫ����Aһ����CO2 �� ��ΪCO��CuO��Ӧ�Ļ�ѧ����ʽΪ �� �����������ۡ�
����Ϊ�IJ��벻һ����ȷ����ɫ����A����CO2�⣬���ܺ�CO�������� ��
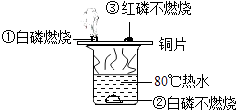
��2����̽���뷴˼�� Ϊ��֤�IJ��룬��Ұ�����ͼʾ����ʵ�飬�����������£���ͷ��ʾ��������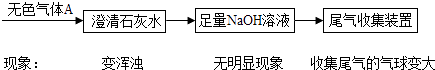
�ɴˣ�����Ϊ�IJ�����ѡ���ȷ������ȷ��������д����ɫ����A�е�CO2ʹ�����ʯ��ˮ����ǵĻ�ѧ����ʽ ��
��3��Ϊ��֤�ҵIJ��룬��Ұ�����ͼʾ����ʵ��̽�������̺��������£� 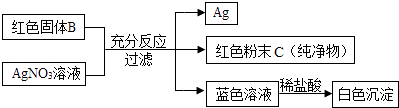
Ϊ̽����ɫ��ĩC����ɣ���ͬѧ��������ʵ�飺
ȡϴ������ɵ�7.2g��ɫ��ĩC�����ڴ��������м��ȣ��۲쵽��ĩ�ɺ�ɫ��Ϊ��ɫ����ַ�Ӧ����ȴ������������Ϊ8.0g�����ú�ɫ��ĩ��������ϡ�����У���ɫ��ĩȫ���ܽ⣬�õ���ɫ��Һ��
��ҷ��������ۡ����㣬���ó���ɫ��ĩC�����Ԫ���� �� ��Ԫ�ص�������Ϊ �� ��ɫ��ĩC�Ļ�ѧʽΪ ��
���𰸡�
��1��CO+CuO ![]() Cu+CO2��һ����̼����
Cu+CO2��һ����̼����
��2������ȷ��Ca��OH��2+CO2=CaCO3��+H2O
��3��ͭ������ͭ����=8��1��Cu2O
���������⣺����������衿����Ϊ��ɫ����Aһ����CO2 �� ��ΪCO��CuO��Ӧ����ͭ�Ͷ�����̼�����Դ��ǣ�CO+CuO ![]() Cu+CO2�����������ۡ�����Ϊ�IJ��벻һ����ȷ����ɫ����A����CO2�⣬���ܺ�CO��������һ����̼���������Դ��ǣ�һ����̼���� ��̽���뷴˼����2��Ϊ��֤�IJ��룬ͨ�����ʵ�飬�۲�����������IJ����Dz���ȷ�ģ�������̼���������Ʒ�Ӧ����̼��ư�ɫ������ˮ�����Դ��ǣ�����ȷ��Ca��OH��2+CO2=CaCO3��+H2O��3��ͨ��̽�������ҵ�����ͼ�������жϺ�ɫ����B��ͭ��������ͭ����ɫ����C��������ͭ��ͭ+1�ۣ�����2�ۣ����������ͭ�Ļ�ѧʽΪCu2O��ͭ������������=64��2��16=8��1�����Դ��ǣ�ͭ������ͭ����=8��1��Cu2O
Cu+CO2�����������ۡ�����Ϊ�IJ��벻һ����ȷ����ɫ����A����CO2�⣬���ܺ�CO��������һ����̼���������Դ��ǣ�һ����̼���� ��̽���뷴˼����2��Ϊ��֤�IJ��룬ͨ�����ʵ�飬�۲�����������IJ����Dz���ȷ�ģ�������̼���������Ʒ�Ӧ����̼��ư�ɫ������ˮ�����Դ��ǣ�����ȷ��Ca��OH��2+CO2=CaCO3��+H2O��3��ͨ��̽�������ҵ�����ͼ�������жϺ�ɫ����B��ͭ��������ͭ����ɫ����C��������ͭ��ͭ+1�ۣ�����2�ۣ����������ͭ�Ļ�ѧʽΪCu2O��ͭ������������=64��2��16=8��1�����Դ��ǣ�ͭ������ͭ����=8��1��Cu2O
�����㾫�����������⣬������Ҫ�˽������̼�Ļ�ѧ����(��ѧ���ʣ�һ������²���ȼ��,Ҳ��֧��ȼ�գ����ܹ�����������ˮ��Ӧ����̼���ʹ�����ʯ��ˮ����ǣ������ȵ�̼��Ӧ)����Ҫ����һ����̼������(һ����̼���������ʣ���ɫ����ζ�����壬�ܶȱȿ�����С��������ˮ��һ����̼�Ļ�ѧ���ʣ���ȼ�Ժͻ�ԭ��)�����֪ʶ���Ǵ���Ĺؼ���