题目内容
【题目】某兴趣小组开展“测定密闭容器中某种气体的体积分数”的探究实验。
(实验步骤)
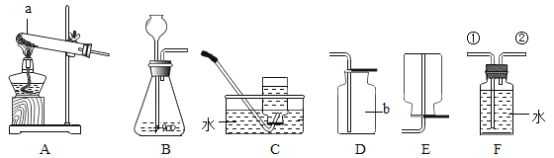
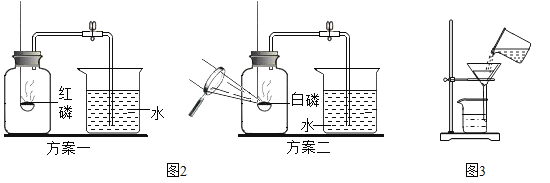
实验1:按图1所示装置,用红磷燃烧的方法测定空气中氧气的体积分数。
实验2:按图2所示装置,在集气瓶内壁用水均匀涂附铁粉除氧剂(其中辅助成分不干扰实验),利用铁锈蚀原理测定空气中氧气的体积分数。
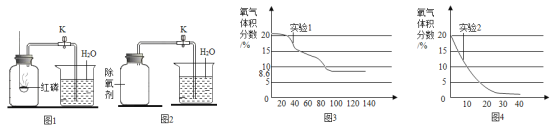
(实验现象)
实验1中,红磷燃烧的主要现象是_____;红磷燃烧的文字或符号表达式_____。红磷熄灭后,集气瓶冷却至室温,打开K,水能倒吸入集气瓶的原因是_____,若发现进入装置中的水少于1/5,可能的原因是_____。
(分析实验)
(1)连接数字传感器,测得实验1、实验2中氧气的体积分数随时间变化的关系分别如图3、图4所示。依据图3,图4信息,_____(填“实验1”或“实验2”)的测定方法更准确,判断依据是_____。
(2)结合你的学习经验,若要寻找红磷或铁粉除氧剂的替代物,用图1或图2装置测定空气中氧气的体积分数,该替代物应满足的条件是_____、_____(写两点)。
(拓展延伸)兴趣小组又利用下图装置继续实验,将装有足量红磷的燃烧匙置于瓶内中间,并把装有足量白磷的燃烧匙浸没在蒸馏水下。先在烧瓶内用激光笔引燃红磷,待红磷燃烧熄灭后,将装有白磷的燃烧匙提出水面,发现白磷可以被点燃继续燃烧。图乙表示用氧气传感器测量的容器内氧气浓度变化曲线图。
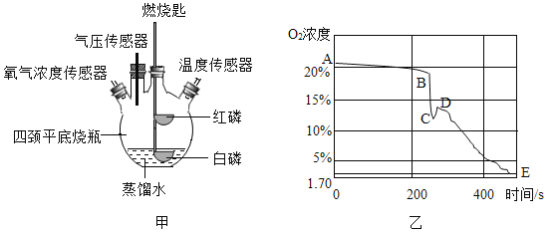
(1)BC段变化的原因:_____;
(2)CD段变化的原因:_____;
(3)DE段变化的原因:_____;
(4)通过红磷和白磷的连续实验得出的结论是:_____。
【答案】产生大量白烟,放热 红磷+氧气![]() 五氧化二磷 红磷燃烧,消耗了氧气,瓶内压强减小,小于外界气压,所以水会回流 装置漏气或红磷的量少或未冷却到室温,便打开止水夹 实验2 反应后,实验1集气瓶内剩余氧气体积分数是8.6%,实验2集气瓶内氧气几乎要耗尽 药品只与空气中的氧气反应 生成物不能是气体 红磷燃烧消耗瓶内氧气 红磷熄灭后,下层未消耗的氧气上浮 白磷燃烧消耗瓶内氧气 红磷燃烧不能完全消耗瓶内氧气(答案合理即可)
五氧化二磷 红磷燃烧,消耗了氧气,瓶内压强减小,小于外界气压,所以水会回流 装置漏气或红磷的量少或未冷却到室温,便打开止水夹 实验2 反应后,实验1集气瓶内剩余氧气体积分数是8.6%,实验2集气瓶内氧气几乎要耗尽 药品只与空气中的氧气反应 生成物不能是气体 红磷燃烧消耗瓶内氧气 红磷熄灭后,下层未消耗的氧气上浮 白磷燃烧消耗瓶内氧气 红磷燃烧不能完全消耗瓶内氧气(答案合理即可)
【解析】
实验1中,红磷燃烧的主要现象是:产生大量白烟,放热;红磷在空气中燃烧产生五氧化二磷的文字表达式:红磷+氧气![]() 五氧化二磷。红磷熄灭后,集气瓶冷却至室温,打开K,水能倒吸入集气瓶的原因是:红磷燃烧,消耗了氧气,瓶内压强减小,小于外界气压,所以水会回流,若发现进入装置中的水少于1/5,可能的原因是:装置漏气或红磷的量少或未冷却到室温,便打开止水夹;
五氧化二磷。红磷熄灭后,集气瓶冷却至室温,打开K,水能倒吸入集气瓶的原因是:红磷燃烧,消耗了氧气,瓶内压强减小,小于外界气压,所以水会回流,若发现进入装置中的水少于1/5,可能的原因是:装置漏气或红磷的量少或未冷却到室温,便打开止水夹;
(1)连接数字传感器,测得实验1、实验2中氧气的体积分数随时间变化的关系分别如图3、图4所示。依据图3,图4信息,实验2 的测定方法更准确,判断依据是:反应后,实验1集气瓶内剩余氧气体积分数是8.6%,实验2集气瓶内氧气几乎要耗尽;
(2)若要寻找红磷或铁粉除氧剂的替代物,用图1或图2装置测定空气中氧气的体积分数,该替代物应满足的条件是1、药品只与空气中的氧气反应2、生成物不能是气体,否则影响最终内的压强变化;
(1)BC段变化的原因:红磷燃烧消耗瓶内氧气 ,氧浓度降低
(2)CD段变化的原因:红磷熄灭后,下层未消耗的氧气上浮,氧含量出现波动;
(3)DE段变化的原因:白磷燃烧消继续耗瓶内氧气,基本将氧气消耗完全;
(4)通过红磷和白磷的连续实验得出的结论是:红磷燃烧不能完全消耗瓶内氧气,白磷基本可以。

 阅读快车系列答案
阅读快车系列答案