题目内容
【题目】某石灰石厂实验室用5.55g石灰石样品高温煅烧制得生石灰(主要成分为氧化钙),实验室过程中进行了四次称量,记录数据如下表(杂质不参加反应,也不分解)
操作次数 | 1 | 2 | 3 | 4 |
剩余固体质量(g) | 4.25 | 3.95 | 3.35 | 3.35 |
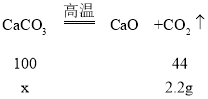
(提示:CaCO3![]() CaO+CO2 )计算:
CaO+CO2 )计算:
(1)完全反应后生成二氧化碳_____克。
(2)石灰石中碳酸钙的质量分数是___。(要求计算完整过程,计算结果精确到0.1%)
(3)所得产品生石灰中钙元素的质量是___。(要求计算完整过程。提示:杂质中不含钙元素)
【答案】2.2 90.1% 2g
【解析】
解:(1)根据质量守恒定律,生成的二氧化碳的质量为:5.55g﹣3.35g=2.2g。
(2)根据表中数据可知,碳酸钙完全反应时生成了2.2g二氧化碳,设石灰石中碳酸钙的质量x。
![]()
![]() ,解答x=5g
,解答x=5g
石灰石中碳酸钙的质量分数为:![]() ≈90.1%
≈90.1%
(3)根据化学反应前后各种元素的质量相等,石灰石中碳酸钙中钙元素的质量=所得产品生石灰中钙元素的质量,为:5g×![]() =2g
=2g
答:(1)完全反应后生成二氧化碳2.2克。
(2)石灰石中碳酸钙的质量分数是90.1%。
(3)所得产品生石灰中钙元素的质量是2g。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】某兴趣小組为测定石灰石中碳酸钙的质量分数,取12g石灰石样品加入烧杯中,将120g稀盐酸平均分四次加入,充分反应后(杂质不溶于水也不与稀盐酸反应),测得实验数据如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸的质量/g | 30 | 30 | 30 | 30 |
剩余固体的质量/g | 9 | 6 | 3 | 2 |
分析数据计算(結果精确到0.1%):
(1)该祥品中碳酸钙的质量分数为__________。
(2)所用稀盐酸的溶质质量分数为__________。
(3)12g样品中的碳酸钙恰好完全反应时所得溶液的溶质质量分数为__________。
【题目】一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 50 | 2 | 0 | 0 |
反应后的质量/g | 23 | X | 24 | 3 |
A. x的值等于2B. 甲一定是化合物
C. 该反应是化合反应D. 反应时丙和丁的质量比为8:1
【题目】请完成下列实验,回答问题。
(1)某同学将氢气与空气混合,在安全保障下在老师指导下点燃,实验如下
V(H2)/V(空气) | 1:99 | 3:97 | 4:96 | 50:50 | 70:30 | 75:25 |
点火 | 不炸 | 不炸 | 炸 | 炸 | 炸 | 不炸 |
①该实验说明氢气的爆炸极限范围可能为______~______之间(用百分数表示)
②鉴于该实验爆炸的危险性,说明点燃氢气前必须验纯,验纯的操作为_____
③该实验证明水是由__________________组成的。
(2)除去下列物质中的杂质,所用试剂错误的是___
选项 | 物质 | 杂质 | 除杂试剂 |
A | 铜 | 氧化铜 | 稀硫酸 |
B | 二氧化碳 | 水蒸气 | 生石灰 |
C | 盐酸 | 硫酸 | 氯化钡溶液 |
D | 氯化钡溶 | 氯化钠溶液 | 碳酸钠溶液 |