题目内容
 溶液在生产和生活中有重要意义.
溶液在生产和生活中有重要意义.
①配制500g0.9%的生理盐水需要称量氯化钠________g,完成此实验正确的操作顺序是(填序号)________.
a.溶解 b.称量 c.计算
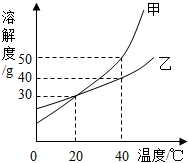
②如图是A、B、C三种固体物质的溶解度曲线,A、C两种物质溶解度曲线的交点为P,回答下列相关问题:
I.点P的含义是________;
II.t2℃时,A、B、C三种物质的溶解度从大到小的关系是________;
III.t2℃时,将A、B、C三种物质各25g分别放入100g水中,充分溶解后,能形成饱和溶液的是________,将其转化为不饱和溶液可采用的方法有________、________.
IV.将t1℃时A、B、C三种物质的饱和溶液升温到t2℃,所得溶液中溶质的质量分数最大的是________.
4.5 cba t1℃,A、B的溶解度相等 A>B>C C 降温 加水 B
分析:①依据溶质的质量=溶液的质量×溶质的质量分数,及配制溶液的步骤分析解答;
②Ⅰ、溶解度曲线的交点表示此温度下两物质的溶解度相同;
Ⅱ、据溶解度曲线可比较同一温度下物质的溶解度大小;
Ⅲ、据t2℃时三种物质的溶解度分析解答,并结合饱和溶液、不饱和溶液的转化措施分析解答;
Ⅳ、据物质的溶解度随温度的变化及饱和溶液中溶质的质量分数分析判断.
解答:①配制500g0.9%的生理盐水需要称量氯化钠500g×0.9%=4.5g,完成此实验正确的操作顺序是计算、称量、溶解;
②I.点P的含义是t1℃,A、B的溶解度相等;
Ⅱ、t2℃时,A、B、C三种物质的溶解度从大到小的关系是A>B>C;
III.观察溶解度曲线可知:t2℃时,AB的溶解度大于25g,C的溶解度小于25g,所以将A、B、C三种物质各25g分别放入100g水中,充分溶解后,能形成饱和溶液的是C;C的溶解度随温度的升高而降低,所以将其转化为不饱和溶液可采用降温、加水的方法;
IV.AB的溶解度随温度的升高而增大,C的溶解度随温度的升高而减小,所以将t1℃时A、B、C三种物质的饱和溶液升温到t2℃,AB变为不饱和溶液,溶质质量分数与t1℃时相同,C的溶解度减小,析出晶体,溶质的质量分数减小,根据饱和溶液中溶解度越大溶质的质量分数越大可知,t1℃时B的溶解度最大则升温后所得溶液中溶质的质量分数依然最大;
故答案为:①4.5g;cba;
②Ⅰ、t1℃,A、B的溶解度相等;
Ⅱ、A>B>C;
Ⅲ、C;降温;加水;
Ⅳ、B.
点评:本题结合溶解度曲线考查了溶解度曲线的应用,解答时要在掌握溶解度的概念、饱和溶液中溶质质量分数的计算方法的基础上分析解答,能较好考查学生分析解决问题的能力,同时考查了溶液配制的相关知识.
分析:①依据溶质的质量=溶液的质量×溶质的质量分数,及配制溶液的步骤分析解答;
②Ⅰ、溶解度曲线的交点表示此温度下两物质的溶解度相同;
Ⅱ、据溶解度曲线可比较同一温度下物质的溶解度大小;
Ⅲ、据t2℃时三种物质的溶解度分析解答,并结合饱和溶液、不饱和溶液的转化措施分析解答;
Ⅳ、据物质的溶解度随温度的变化及饱和溶液中溶质的质量分数分析判断.
解答:①配制500g0.9%的生理盐水需要称量氯化钠500g×0.9%=4.5g,完成此实验正确的操作顺序是计算、称量、溶解;
②I.点P的含义是t1℃,A、B的溶解度相等;
Ⅱ、t2℃时,A、B、C三种物质的溶解度从大到小的关系是A>B>C;
III.观察溶解度曲线可知:t2℃时,AB的溶解度大于25g,C的溶解度小于25g,所以将A、B、C三种物质各25g分别放入100g水中,充分溶解后,能形成饱和溶液的是C;C的溶解度随温度的升高而降低,所以将其转化为不饱和溶液可采用降温、加水的方法;
IV.AB的溶解度随温度的升高而增大,C的溶解度随温度的升高而减小,所以将t1℃时A、B、C三种物质的饱和溶液升温到t2℃,AB变为不饱和溶液,溶质质量分数与t1℃时相同,C的溶解度减小,析出晶体,溶质的质量分数减小,根据饱和溶液中溶解度越大溶质的质量分数越大可知,t1℃时B的溶解度最大则升温后所得溶液中溶质的质量分数依然最大;
故答案为:①4.5g;cba;
②Ⅰ、t1℃,A、B的溶解度相等;
Ⅱ、A>B>C;
Ⅲ、C;降温;加水;
Ⅳ、B.
点评:本题结合溶解度曲线考查了溶解度曲线的应用,解答时要在掌握溶解度的概念、饱和溶液中溶质质量分数的计算方法的基础上分析解答,能较好考查学生分析解决问题的能力,同时考查了溶液配制的相关知识.

练习册系列答案
相关题目
 溶液在生产和生活中有重要意义.
溶液在生产和生活中有重要意义. 28、 溶液在生产和生活中有重要意义.
28、 溶液在生产和生活中有重要意义.

 (2009?西宁)溶液在生产和生活中有重要意义.
(2009?西宁)溶液在生产和生活中有重要意义.