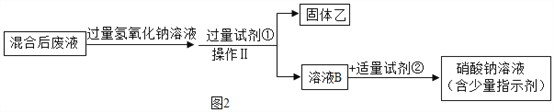
题目内容
【题目】某化学兴趣小组利用以下装置探究气体的制取及性质。
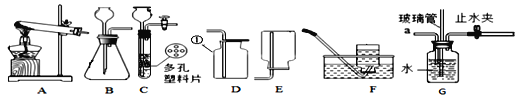
(1)①用高锰酸钾制取氧气,应选择_____________(填序号)为气体发生装置,反应化学方程式为____________________________________,充分反应后,高锰酸钾中的氧元素转化为氧气的最大转化率为_________(填序号);
a.25% b.33.3% c.50% d.100%
②为防止高锰酸钾粉末进入导管,应采取的措施是__________(填序号)
a.润湿玻璃管 b.检查气密性 c.均匀预热 d.在试管口附近放一团棉花
(2)①用装置C制取二氧化碳,多孔塑料片上常放置的药品为_______________,此装置与B装置相比,最大的优点是____________________________。
②用D装置收集二氧化碳的方法叫__________法,其中仪器①的名称为________;检验二氧化碳气体的反应化学方程式为____________________________。
(3)①用锌粒与稀硫酸制取氢气,用装置_________(填序号)可以收集较纯净氢气;
②点燃不纯的氢气可能发生爆炸。图G是某同学的改进装置:若将氢气的发生装置与导管a连接,松开止水夹,在导管口点燃气体,发生装置不会爆炸。此装置的作用是_______(填序号)
a.提高了气体纯度 b.阻止气体在发生装置内燃烧 c.改变了氢气的化学性质
③若要图H中的两个气球悬浮在空气中,则气体甲可能是_________(填序号)。
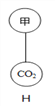
a.空气 b.氧气 c.氢气
【答案】 A 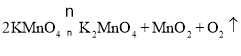 a d 石灰石(或大理石) 可控制反应的开始与结束 向上排空气法 集气瓶 CO2+Ca(OH)2=CaCO3↓+H2O F b c
a d 石灰石(或大理石) 可控制反应的开始与结束 向上排空气法 集气瓶 CO2+Ca(OH)2=CaCO3↓+H2O F b c
【解析】(1)①根据反应物的状态、反应条件、反应原理分析解答;②为了防止高锰酸钾进入导管,通常在试管口塞一团棉花;(2)①根据实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳及装置的特点分析解答;②根据二氧化碳的密度比空气大解答;根据常见仪器解答;根据二氧化碳与澄清石灰水反应生成碳酸钙沉淀和水解答;(3)①根据用排水法收集的气体较纯解答;②根据爆炸的原理和条件进行分析;③根据图H中下方气球内装的气体是二氧化碳,密度比空气大,则上方的气体密度应比空气小解答。(1)①高锰酸钾是固体在加热的条件下分解生成锰酸钾、二氧化锰和氧气。应选择A为气体发生装置,反应的化学方程式为2KMnO4△K2MnO4+MnO2+O2↑;每316份质量的高锰酸钾完全反应生成32份质量的氧气。316份质量的高锰酸钾中氧气的质量为128份。故充分反应后,高锰酸钾中的氧元素转化为氧气的最大转化率为![]() ×100%=25%,故选a;②为防止高锰酸钾粉末进入导管,应采取的措施是在试管口附近放一团棉花,故选d;(2)①用装置C制取二氧化碳,多孔塑料片上常放置的药品为石灰石(或大理石),此装置与B装置相比,最大的优点是可控制反应的开始与结束;②二氧化碳的密度比空气大,用D装置收集二氧化碳的方法叫向上排空气法,其中仪器①的名称为集气瓶;检验二氧化碳气体的反应化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;(3)①用锌粒与稀硫酸制取氢气,用装置F可以收集较纯净氢气;②若在导管a处通入可燃性气体,在导管b处连上尖嘴管并松开止水夹,点燃,即使气体不纯也不会爆炸,此装置的作用是阻断燃烧,故选b;③图H中下方气球内装的气体是二氧化碳,密度比空气大,则上方的气体密度应比空气小,所以该气体是氢气,故选c。
×100%=25%,故选a;②为防止高锰酸钾粉末进入导管,应采取的措施是在试管口附近放一团棉花,故选d;(2)①用装置C制取二氧化碳,多孔塑料片上常放置的药品为石灰石(或大理石),此装置与B装置相比,最大的优点是可控制反应的开始与结束;②二氧化碳的密度比空气大,用D装置收集二氧化碳的方法叫向上排空气法,其中仪器①的名称为集气瓶;检验二氧化碳气体的反应化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;(3)①用锌粒与稀硫酸制取氢气,用装置F可以收集较纯净氢气;②若在导管a处通入可燃性气体,在导管b处连上尖嘴管并松开止水夹,点燃,即使气体不纯也不会爆炸,此装置的作用是阻断燃烧,故选b;③图H中下方气球内装的气体是二氧化碳,密度比空气大,则上方的气体密度应比空气小,所以该气体是氢气,故选c。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
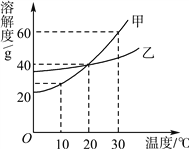
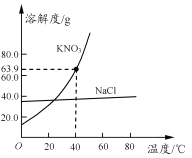
小学生10分钟应用题系列答案【题目】分析处理图表的信息是学习化学的一种重要方法。下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
(1)40 ℃时,氯化钠的溶解度为________g。
(2)碳酸钠的溶解度随温度的升高而________(填“增大”或“减小”)。在20 ℃时,在100 g的水中加入30 g碳酸钠,充分搅拌后得到的是________(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30 ℃,该溶液的溶质质量分数为________(计算结果精确到0.1%)。
(3)10 ℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是________________________________________________________________________。