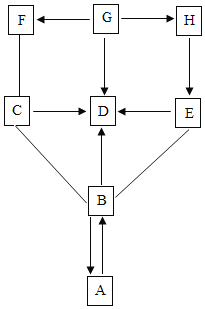
��Ŀ����
����Ŀ���ס������ֹ������ʵ��ܽ��������ͼ��ʾ����ش�

��1�� ______��ʱ�������������ʵ��ܽ����ȣ�
��2���ܽ�����¶ȵ����߶���С���� __________
��3������һ���¶��������ʵı�����Һ��Ϊ��������Һ���ɲ��õķ����� __________��
��4�������к��������ң�Ӧ�� ______________�ķ����ᴿ�ף�
��5�����������ס����������ʷֱ����t2��ʱ�ı�����Һ����Ҫˮ��������С��ϵ�ǣ���______�ң�������������=������������
���𰸡�t1 �� �����ܼ� ���½ᾧ ��
��������
��1��ͨ�������ܽ�����߿�֪��t1��ʱ�������������ʵ��ܽ����ȣ�
��2���ܽ�����¶ȵ����߶���С���ǣ��ң�
��3������һ���¶��������ʵı�����Һ��Ϊ��������Һ���ɲ��õķ����ǣ������ܼ���
��4���ס��ҵ��ܽ�����¶ȵ����߶������ܽ�����¶�Ӱ��ϴ��ҵ��ܽ�����¶�Ӱ���С�����Լ��к��������ң�Ӧ�ý��½ᾧ�ķ����ᴿ�ף�
��5��t2��ʱ�������ʵ��ܽ�ȴ��������ʵ��ܽ�ȣ����Խ��������ס����������ʷֱ����t2��ʱ�ı�����Һ����Ҫˮ��������С��ϵ�ǣ��ף��ҡ�

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
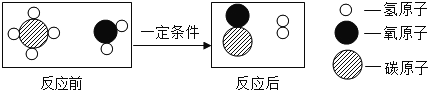
â���̸������Ծ�ϵ�д�����Ŀ����100gBaCl2��Һ�еμ�Na2SO4��Һ����ȫ��Ӧ����Ӧ���������ɳ�����������μ�Na2SO4��Һ��������ϵ�����ʾ������Ӧ�Ļ�ѧ����ʽ��BaCl2+Na2SO4=BaSO4��+2NaCl��������㣺
�μ�Na2SO4��Һ������/g | 10 | 20 | 30 | 40 |
���ɳ���������/g | 2.33 | 4.66 | 6.99 | 6.99 |
��1��Na2SO4����Է�������Ϊ______________��
��2��ǡ����ȫ��Ӧʱ����BaSO4������Ϊ ______g
��3��BaCl2��Һ�����ʵ���������___________��д��������̣�
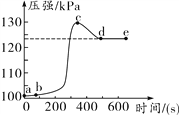
����Ŀ��Ϊ����֤�����غ㶨�ɣ�ͬѧ������ˡ�ϡ�����̼���Ʒ�ĩ��Ӧǰ�������ⶨ��ʵ�飬��ͼ��ʾ������ʹ��һ�����̽����
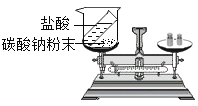
��1������ͼ��ʽʵ�飬���ձ���б��ʹϡ������̼���Ʒ�ĩ�Ӵ�����ʵ���У���ҽ��������γ��������ĸ�С��õ��������ݣ����������������������________������ţ���
A | B | C | D | |
ϡ�������̼���Ʒ�ĩǰ����/ | 86.5 | 86.8 | 84.8 | 86.5 |
ϡ�������̼���Ʒ�ĩ�����/ | 86.5 | 81.6 | 79.7 | 87.8 |
��2��С�����ַ�Ӧֹͣ����ƽָ������ƫת���������������ԭ�������________���÷�Ӧ________������ء������ء��������غ㶨�ɡ�
��3������ʦ�����£�ͬѧ����ʶ��Ҫͨ����ʵ����֤�����غ㶨�ɣ���Ӧ������________________�������н��С�