题目内容
 课题小组为测定某黄铜样品中铜的含量,取20g黄铜样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈右图所示关系.请完成下列计算内容:
课题小组为测定某黄铜样品中铜的含量,取20g黄铜样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈右图所示关系.请完成下列计算内容:(1)试验中产生气体的质量是
(2)样品中铜的质量分数是多少?
(3)所用稀盐酸的质量分数是多少?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)由图中数据可知气体的质量;
(2)根据氢气的质量可以求出锌的质量,进而求得铜的质量分数;
(3)根据氢气的质量求出100g盐酸中氯化氢的质量,进而求其质量分数.
(2)根据氢气的质量可以求出锌的质量,进而求得铜的质量分数;
(3)根据氢气的质量求出100g盐酸中氯化氢的质量,进而求其质量分数.
解答:解:(1)由图中数据可知产生氢气的质量为0.5g,
故答案为:0.5g;
设黄铜样品中锌的质量为x,100g盐酸中氯化氢的质量为y
Zn+2HCl=ZnCl2+H2↑
65 73 2
x y 0.5g
=
,
=
x=16.25g,y=18.25g
(2)样品中铜的质量分数是:
×100%=18.75%
答:样品中铜的质量分数是18.75%;
(3)所用稀盐酸的质量分数是:
×100%=18.25%
答:所用稀盐酸的质量分数是18.25%.
故答案为:0.5g;
设黄铜样品中锌的质量为x,100g盐酸中氯化氢的质量为y
Zn+2HCl=ZnCl2+H2↑
65 73 2
x y 0.5g
| 65 |
| 2 |
| x |
| 0.5g |
| 73 |
| 2 |
| y |
| 0.5g |
x=16.25g,y=18.25g
(2)样品中铜的质量分数是:
| 20g-16.25g |
| 20g |
答:样品中铜的质量分数是18.75%;
(3)所用稀盐酸的质量分数是:
| 18.25g |
| 100g |
答:所用稀盐酸的质量分数是18.25%.
点评:本题主要考查根据化学方程式的计算以及质量分数的计算,要注意计算步骤和格式.

练习册系列答案
相关题目

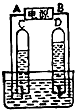 阿伏加德罗曾经总结出下列一条定律:“在同温同压下,同体积的任何气体都含有相同数量的分子.”请看图简易电解水的装置,回答下列问题:?
阿伏加德罗曾经总结出下列一条定律:“在同温同压下,同体积的任何气体都含有相同数量的分子.”请看图简易电解水的装置,回答下列问题:?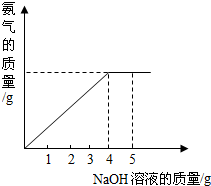 硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
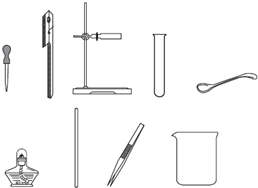 如图是实验室常用的仪器,请用图中仪器的名称按要求填空.
如图是实验室常用的仪器,请用图中仪器的名称按要求填空.