题目内容
【题目】小芳同学采用如下方法测定石灰石中碳酸钙的质量分数:取该石灰石样品10g, 把40g稀盐酸分四次加入,实验过程所得数据如下表(石灰石样品中含有的二氧化硅等杂质不溶于水也不与稀盐酸反应)。
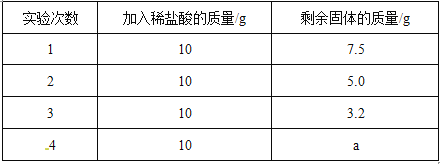
根据实验数据计算:
(1)表中a的数值为__________。
(2)样品中碳酸钙的质量分数是________________。
(3)求盐酸中溶质的质量分数。
【答案】(1)3.2(2)68%(3)18.25%
【解析】
试题分析:(1)数据的分析处理,先找出数据变化的规律,很明显此时数据的规律是:每加入稀盐酸10g,碳酸钙质量减少2.5g,但第3次实验质量减少=5.0g-3.2g=1.8g≠2.5g,说明反应结束,碳酸钙完全反应,盐酸过量,故即使再加入稀盐酸,剩余的固体质量不会变化,所以表中a的数值为3.2。
(2)根据上面分析,3.2g即为石灰石样品中杂质的质量,故样品中碳酸钙的质量分数=(10-3.2)÷10×100%=68%。
(3)根据上面的分析,此时计算宜选取的数据应为第1或2次实验的数据,根据化学方程式CaCO3 + 2HCl== CaCl2 + H2O + CO2↑中CaCO3与HCl的质量关系,可计算出HCl的质量,进一步计算盐酸中溶质的质量分数。
解:设第一次加入的10g盐酸中溶质的质量为x,则有:
CaCO3 + 2HCl== CaCl2 + H2O + CO2↑
100 73
10g-7.5g x
100/73=(10g-7.5g)/x
X=1.825g
1.825g/10g×100%=18.25%
答:盐酸中溶质的质量分数是18.25%

练习册系列答案
相关题目