题目内容
【题目】如图为干电池的结构示意图,请利用所学知识完成下列问题。
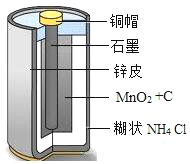
(l)碳棒(主要成分是石墨)可用作干电池的电极,说明石墨具有_____________性。
(2)把NH4Cl配制成溶液,并结合下表填空。
①通过观察上表可知,NH4Cl溶液的 pH___________(填“>”“<”或者“=”)7。
②上表中属于碱性氮肥的是____________。
(3)干电池中用到了铜和锌两种金属,请你写出一种证明两种金属活动性强弱的方案,(写操作和现象)___________。
溶液 | K2SO4 溶液 | NH4Cl 溶液 | 氨水 | K2CO3 溶液 |
加入紫色石蕊溶液 | 紫色 | 红色 | 蓝色 | 蓝色 |
(4)干电池的材料很多可以回收利用。例如:回收的二氧化锰在实验室制取氧气时,所起的作用是 _____________; 干电池中的锌壳可以回收用于实验室制取氢气,反应的化学方程式为___________。
【答案】导电 < 氨水 将锌片放入硫酸铜溶液中,锌片上有红色物质析出(或铜放入硫酸锌溶液中,无任何现象) 催化作用 Zn+H2SO4=ZnSO4+H2↑
【解析】
锌和硫酸铜反应生成硫酸锌和铜,过氧化氢在二氧化锰催化作用下生成水和氧气,氯化铵能使紫色石蕊溶液变红色,则氯化铵溶液显酸性,氨水能使能使紫色石蕊溶液变蓝色,则氨水显碱性,锌和稀硫酸生成硫酸锌和氢气。
(l)碳棒(主要成分是石墨)可用作干电池的电极,说明石墨具有导电性。
(2)①通过观察上表可知,氯化铵能使紫色石蕊溶液变红色,则氯化铵溶液显酸性,故NH4Cl溶液的 pH<7。
②氨水能使能使紫色石蕊溶液变蓝色,则氨水显碱性,氨水中含有氮元素,可以做氮肥。
(3)干电池中用到了铜和锌两种金属,锌和硫酸铜反应生成硫酸锌和铜,故证明两种金属活动性强弱的方案是将锌片放入硫酸铜溶液中,锌片上有红色物质析出(或铜放入硫酸锌溶液中,无任何现象)。
(4)回收的二氧化锰在实验室制取氧气的反应是过氧化氢在二氧化锰催化作用下生成水和氧气,故所起的作用是催化作用;干电池中的锌壳可以回收用于实验室制取氢气,反应是锌和稀硫酸生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】下列对客观事实书写的化学方程式及其反应类型都正确的是( )
选项 | 客观事实 | 化学方程式 | 基本反应类型 |
A | 铁丝在氧气中燃烧 | 2Fe+3O2 | 化合反应 |
B | 加热高锰酸钾 | 2KMnO4 | 分解反应 |
C | 乙醇燃烧 | C2H5OH+3O2 | 氧化反应 |
D | 硫酸钾溶液和氯化钡溶液反应 | K2SO4+BaCl2=2KCl +BaSO4 | 复分解反应 |
A.AB.BC.CD.D