题目内容
【题目】某固体混合物的主要成分有碳酸钙和氯化钙(氯化钙不与盐酸反应).为探究混合物中碳酸钙的质量分数,甲、乙两个小组同学分别进行了实验:
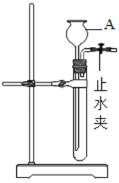
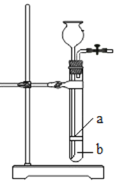
(1)甲组同学按以下流程进行实验:
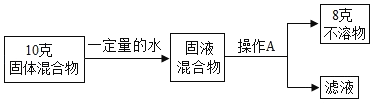
①操作A的名称_____.
②混合物中碳酸钙的质量分数可能_____80% 或_____80%(填“>”、“<”或“=”).
(2)乙组的5名同学分别在一个质量为40.00的空烧杯中加入各自称好的固体混合物,然后将质量分数不同的36.50g稀盐酸加入烧杯中,实验数据如表:(假设反应过程中各物质均没有损失)
组号 | 烧杯及物质的总质量(g) | 稀盐酸溶质质量分数(%) | 产生气体的质量(g) |
1 | 42.00 | 2.00 | 0.44 |
2 | 45.00 | 5.00 | 1.10 |
3 | 44.00 | 9.50 | 1.32 |
4 | 46.00 | 9.50 | 1.98 |
5 | 44.00 | 6.00 | a |
表中a=_____g.
【答案】过滤 = < 1.32
【解析】
(1)①过滤是把溶性固体与液体分离的一种操作,操作后的固液混合物被分离为固体滤渣和滤液;
②过滤后的不溶物的质量若全部为碳酸钙的质量,则固体混合物中碳酸钙的质量分数恰好为80%;若所得不溶物不全部是碳酸钙,则固体混合物中碳酸钙的质量分数小于80%;
(2)对比所得实验数据,1、3对比可得知36.5g2%的稀盐酸完全反应可生成0.44g二氧化碳、4g固体混合物完全反应可生成气体二氧化碳1.32g,并且可推断得出4g固体混合物完全反应需要消耗6%的稀盐酸36.5g。
(1)①A操作后原固液混合物被分离为固体不溶物和滤液,因此,操作A为过滤操作;
②过滤后的固体若未经洗涤、干燥处理,不溶物若附着溶液,所称量不溶物的质量8g不全部为碳酸钙的质量,则固体混合物中碳酸钙的质量分数小于80%;若过滤所得的不溶物质量8g全部为碳酸钙的质量,则固体混合物中碳酸钙的质量分数等于80%;
(2)1、3组数据对比,3组所用药品固体混合物质量增加至2倍,稀盐酸的质量增加至4.75倍,而放出二氧化碳的质量增加至三倍,此现象可说明1组中的固体混合物、3组中稀盐酸未完全反应有剩余,则2%的稀盐酸全部反应产生0.44g气体二氧化碳、4g固体混合物完全反应可生成二氧化碳1.32g;根据此质量关系,5组所取固体混合物和稀盐酸恰好完全反应,生成二氧化碳的质量为1.32g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案