题目内容
【题目】有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。试求:
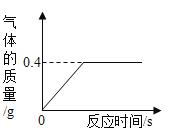
(1)生成气体的质量是 g。
(2)反应后所得溶液中溶质质量分数(计算结果精确至0.1%)。
【答案】(1)0.4
(2)28.6%
【解析】
(1)锌粉与铜粉的混合物样品,加入稀硫酸,只有稀硫酸与锌粉反应,生成硫酸锌和氢气,由图可知,图中曲线最高点的纵坐标表示锌与稀硫酸完全反应,生成氢气的质量,因此,生成气体的质量是0.4g,故填写:0.4;
(2)设混合物中锌的质量为x,反应生成硫酸锌的质量为y

根据质量守恒定律可知,反应后所得溶液质量为:13g+100g-0.4g=112.6g
反应后所得溶液中溶质质量分数:![]()
答:反应后所得溶液中溶质质量分数为28.6%。

【题目】(发现问题)小芳和她的化学兴趣小组对家用普通干电池中的黑色物质产生了兴趣,于是展开如下探究。
(提出问题)黑色物质的成分是什么?
(猜想与假设)查阅资料后,小芳发现黑色粉末里可能含有二氧化锰和炭粉。
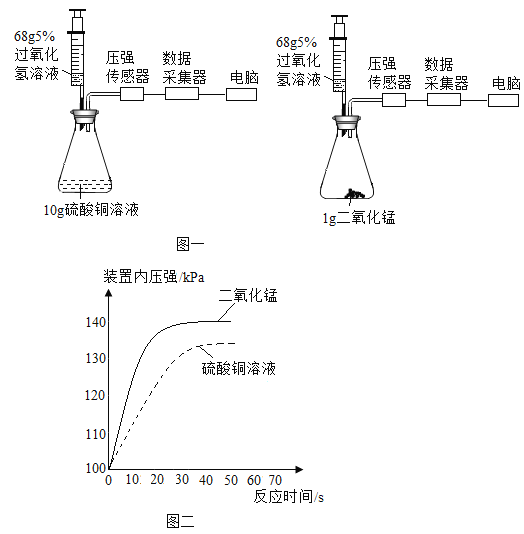
(实验探究)小芳结合自己刚刚学过的知识,设计了利用过氧化氢溶液来验证黑色粉末的成分实验过程。
实验步骤 | 实验操作 | 实验现象 |
选择下图某装置为反应的发生装置,检查装置气密性,进行实验探究。 | 向反应容器中加入待探究的黑色粉末,将过氧化氢溶液加入反应容器中与黑色粉末混合,并将收集到的气体用带火星的木条验证。 | 带火星的木条复燃 |

(1)写出仪器名称:①______________,②___________________;
(2)实验步骤中选用的发生装置是(填字母标号),该反应的符号表达式为_________,该反应的基本反应类型是___________;
(得出结论)黑色粉末中含有二氧化锰。
(反思评价)同组的小华觉得小芳的探究不全面,他觉得应该补充一个探究炭粉是否具有加快过氧化氢溶液反应速率的实验。
(3)结合学过的知识,自己设计实验证明黑色粉末中含有炭粉_____________________。
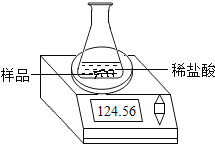
【题目】某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验。实验装置如图所示:称取研细的2.50g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止。测得反应前后的有关质量如表:
(1)反应生成二氧化碳的质量为_____。
(2)计算石灰石样品中CaCO3的质量分数_____。
(3)若在上述实验过程中石灰石样品和所加酸液均无抛洒,根据图中装置判断,该实验结果可能_____(填“偏大”、“偏小”或“准确”)。
反应前,整套装置+样品的质量/g | 共加入:稀盐 酸的质量/g | 反应后,整套装置+锥 形瓶中剩余物的质量/g |
104.60 | 20.00 | 123.72 |
【题目】某化学兴趣小组设计如下实验探究FeCl3溶液的相关性质。
相关信息:Fe和Fe3O4,易被磁铁吸引,FeO是一种黑色固体,不能被磁铁吸引;Fe3O4能与盐酸反应,生成盐和水。FeCl3具有氧化性,与单质铁等物质化合时铁元素化合价会降低。
(1)实验一:将饱和FeCl3溶液在蒸发皿中加热至沸腾后,发现逐渐产生红褐色沉淀,加热时,FeCl3,易与水反应生成红褐色固体物质和盐酸,红色固体的化学式是_______________。
(2)实验二:将实验一蒸发获得的红色固体灼烧,颜色由红色变为红棕色。该反应的化学方程式是__________。
①氢氧化镁,氢氧化铜等物质加热也能分解得到对应的金属氧化物,而氢氧化钠、氢氧化钙等物质则无此性质。结合实验,从物质类别及其溶解性推断,通过加热分解___________可生成对应的金属氧化物。
②将氢氧化镁和铜粉混合物充分加热,得到的固体物质与原混合物质量相同,请问,氢氧化镁和铜粉的质量比为________。
(3)实验三:小组同学用多根玻璃棒蘸取饱和FeCl3溶液于酒精灯火焰上灼烧,在1分钟内观察到玻璃棒表面颜色的变化依次为:黄色、红褐色、红棕色,黑色。
①同学们对黑色物质的成分产生了疑问。联系酒精的可燃性、还原性等相关性质,对黑色物质的成分提出了猜想,经讨论,可能是_______和Fe3O4四种物质中的一种或几种。
②为了确定黑色物质的成分,收集黑色物质,进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取黑色粉末用磁铁吸引,观察现象 | 黑色粉末全部被磁铁吸引 | 综合实验现象判断,此黑色物质成分是_______ |
向装有黑色粉末的试管中加入足量的盐酸,充分反应,观察现象 | 固体逐渐溶解,但无气泡产生 |