题目内容
 (1)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如右图所示.请你计算废水中盐酸的溶质质量分数.(写出具体的计算过程)
(1)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如右图所示.请你计算废水中盐酸的溶质质量分数.(写出具体的计算过程)
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
| 加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度t/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
(3)根据上述曲线变化讨论溶液温度变化的原因.
①加入盐酸的量在2~10mL之间时:______;
②加入盐酸的量在10~20mL之间时:______.
(4)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?答:______.
解:(1)①设氯化氢的质量为X.
NaOH+HCl═NaCl+H2O
40 36.5
20g×2% X
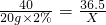 X=0.365g
X=0.365g
稀盐酸的质量分数为: ×100%=0.73%
×100%=0.73%
答:废水中盐酸的溶质质量分数为0.73%.
(2)先根据对应的数值描点,连线即可.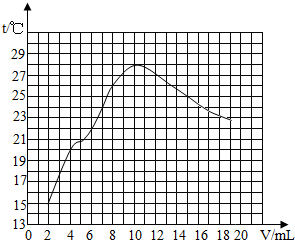
(3)①有表中数据可知,随着盐酸和氢氧化钠溶液反应的不断进行,溶液的温度逐渐升高,说明中和反应是放热反应;②中和反应完毕后,再加入盐酸,溶液温度下降的一种可能原因是加入盐酸起到冷却的作用;
(4)不能用氢氧化钠固体和盐酸反应,因为固体氢氧化钠溶于水也要放热,应该用氢氧化钠溶液和盐酸反应.
分析:(1)根据NaOH和HCl反应的化学方程式,用氢氧化钠溶液中溶质NaOH的量可求出废液中溶质HCl的量,进而求出废液中HCl的质量分数;
(2)先根据对应的数值描点,连线即可;
(3)在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸:①加入盐酸的量在2-10mL之间时:考虑中和反应放出热量;②加入盐酸的量在l0-20mL之间时:考虑反应完成,过量盐酸起冷却降温作用.
(4)不能用氢氧化钠固体和盐酸反应,因为固体氢氧化钠溶于水也要放热,应该用氢氧化钠溶液和盐酸反应.
点评:本题主要考查了根据化学方程式进行相关方面的计算及其中和反应是放热的等方面的内容,要求学生了解物质发生化学变化时的能量变化:中和反应放热.
NaOH+HCl═NaCl+H2O
40 36.5
20g×2% X
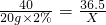 X=0.365g
X=0.365g稀盐酸的质量分数为:
 ×100%=0.73%
×100%=0.73%答:废水中盐酸的溶质质量分数为0.73%.
(2)先根据对应的数值描点,连线即可.

(3)①有表中数据可知,随着盐酸和氢氧化钠溶液反应的不断进行,溶液的温度逐渐升高,说明中和反应是放热反应;②中和反应完毕后,再加入盐酸,溶液温度下降的一种可能原因是加入盐酸起到冷却的作用;
(4)不能用氢氧化钠固体和盐酸反应,因为固体氢氧化钠溶于水也要放热,应该用氢氧化钠溶液和盐酸反应.
分析:(1)根据NaOH和HCl反应的化学方程式,用氢氧化钠溶液中溶质NaOH的量可求出废液中溶质HCl的量,进而求出废液中HCl的质量分数;
(2)先根据对应的数值描点,连线即可;
(3)在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸:①加入盐酸的量在2-10mL之间时:考虑中和反应放出热量;②加入盐酸的量在l0-20mL之间时:考虑反应完成,过量盐酸起冷却降温作用.
(4)不能用氢氧化钠固体和盐酸反应,因为固体氢氧化钠溶于水也要放热,应该用氢氧化钠溶液和盐酸反应.
点评:本题主要考查了根据化学方程式进行相关方面的计算及其中和反应是放热的等方面的内容,要求学生了解物质发生化学变化时的能量变化:中和反应放热.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数 .
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升 mL.
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
试在坐标系中绘出溶液温度变化与加入盐酸体积之间的变化关系图.
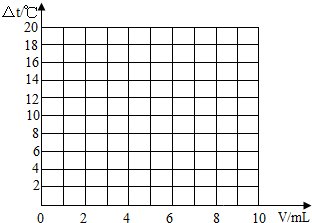
(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识. .
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |

(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识.
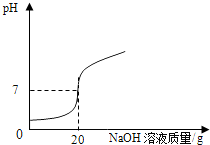 (1)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如右图所示.请你计算废水中盐酸的溶质质量分数.(写出具体的计算过程)
(1)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如右图所示.请你计算废水中盐酸的溶质质量分数.(写出具体的计算过程)在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
| 加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度t/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
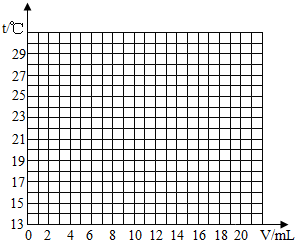
(3)根据上述曲线变化讨论溶液温度变化的原因.
①加入盐酸的量在2~10mL之间时:
②加入盐酸的量在10~20mL之间时:
(4)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?答:
 (2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
(2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数. (2013?苏州模拟)某学校课外活动小组,对某造纸厂废水中NaOH含量进行了测定.取一定量的废水,向其中逐渐滴加溶质质量分数为9.8%的稀硫酸(密度约为l.0g/mL),反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表:
(2013?苏州模拟)某学校课外活动小组,对某造纸厂废水中NaOH含量进行了测定.取一定量的废水,向其中逐渐滴加溶质质量分数为9.8%的稀硫酸(密度约为l.0g/mL),反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表: