题目内容
(2012?泰安)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案.结合实验方案回答下列问题:?
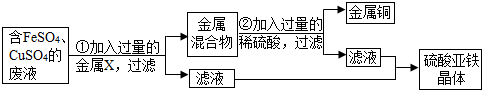
(1)步骤①中,金属X是
(2)步骤②中,加入过量稀硫酸的目的是
(3)从滤液中获得硫酸亚铁晶体采用的方法是

(1)步骤①中,金属X是
?铁(或Fe)
?铁(或Fe)
,该反应的化学方程式为Fe+CuSO4=Cu+FeSO4
Fe+CuSO4=Cu+FeSO4
;?(2)步骤②中,加入过量稀硫酸的目的是
除去铜中的铁
除去铜中的铁
;?(3)从滤液中获得硫酸亚铁晶体采用的方法是
蒸发
蒸发
.?分析:(1)由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;
(2)由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁;
(3)蒸发从溶液中获得晶体常采用的方法.
(2)由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁;
(3)蒸发从溶液中获得晶体常采用的方法.
解答:解:(1)由题意可知,由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.该反应的化学方程式为:Fe+CuSO4 ═FeSO4 +Cu;
(2)步骤②中,加入过量稀硫酸的目的是 除去铜中的铁;?
(3)从滤液中获得硫酸亚铁晶体采用的方法是蒸发.?
故答为:(1)铁,Fe+CuSO4 ═FeSO4 +Cu;(2)除去铜中的铁;(3)蒸发.?
(2)步骤②中,加入过量稀硫酸的目的是 除去铜中的铁;?
(3)从滤液中获得硫酸亚铁晶体采用的方法是蒸发.?
故答为:(1)铁,Fe+CuSO4 ═FeSO4 +Cu;(2)除去铜中的铁;(3)蒸发.?
点评:解答本题时要注意混合物的分离要考虑为彻底分开而加入过量试剂,所以后一环节需要将之除去.

练习册系列答案
相关题目
 (2012?泰安)小明同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中分别加入11.0g样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体.
(2012?泰安)小明同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中分别加入11.0g样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体.