题目内容
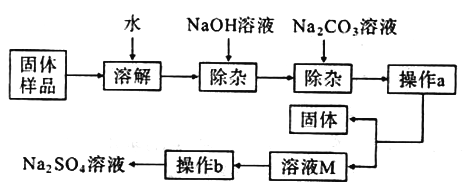
【题目】氯化钡是一种可溶性重金属盐,广泛应用于化工领域。工业上以重晶石(主要成分BaSO4,杂质为Fe2O3)为原料,通过下列流程生成氯化钡晶体(BaCl2·xH2O)并进行组成测定。
已知:①BaSO4+4C![]() 4CO↑+BaS
4CO↑+BaS
②CaO、BaO都能与水反应生成碱

(1)焙烧时,焦炭与杂质Fe2O3也会发生反应,反应方程式为_____;实际生产中必须加入过量焦炭,其目的是使重晶石充分反应,提高产率和_____。
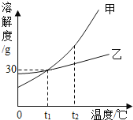
(2)焙烧时,温度和时间对硫酸钡转化率的影响如下图,则最佳温度约为_____℃,时间约为_____min。

(3)酸溶时,硫化钡(BaS)与盐酸发生复分解反应产生硫化氢气体(H2S),该反应方程式为_____;气体X成分除H2S和少量挥发出的HCl、水蒸气外,还含有_____。
(4)除铁反应中试剂Y可以是_____(填字母)。
a.NaOH溶液 b.氨水 c.生石灰 d.BaO固体
证明铁已除尽的方法是:取上层清液于试管中,滴入_____溶液,若无明显现象,则已除尽。
(5)滤渣水洗的目的是提高晶体产率和_____。
(6)测定晶体(BaCl2·xH2O)的组成:
Ⅰ.称取24.4gBaCl2晶体,置于小烧杯中,加入适量蒸馏水,使其全部溶解。
Ⅱ.再边搅拌边滴加稀硫酸到沉淀完全,静置;
Ⅲ.过滤并洗涤沉淀;
Ⅳ.将盛有沉淀的滤纸包烘干并中温灼烧后,称得BaSO4沉淀质量为23.3g。
①通过计算,确定x的值。_____(写出计算过程)
②操作Ⅳ中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果_____(填“偏低”、“偏高”或“不变”)。
【答案】3C+Fe2O3![]() 2Fe+3CO↑ 提供热量(维持反应所需高温) 1000 60 BaS+2HCl=BaCl2+H2S↑ H2 d NaOH(合理即可) 减少废渣中可溶性钡盐对环境的污染(环保) 2 偏高
2Fe+3CO↑ 提供热量(维持反应所需高温) 1000 60 BaS+2HCl=BaCl2+H2S↑ H2 d NaOH(合理即可) 减少废渣中可溶性钡盐对环境的污染(环保) 2 偏高
【解析】
(1)根据题意,碳和氧化铁在高温下反映生成铁和一氧化碳,故填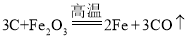 ;通入过量焦炭后,可使重晶石充分反应同时焦炭燃烧可维持反应的高温热量,故填提供热量(维持反应所需高温);
;通入过量焦炭后,可使重晶石充分反应同时焦炭燃烧可维持反应的高温热量,故填提供热量(维持反应所需高温);
(2)根据曲线图所示,在1000℃时,硫酸钡转化率最高,故填1000;根据曲线图所示,时间在60min时,硫酸钡转化率最高,故填60;
(3)硫化钡与盐酸发生复分解反应生成氯化钡和硫化氢气体,故填![]() ;在重晶石中,有氧化铁杂质,经过焦炭高温会生成单质铁,铁和盐酸反应会产生氢气,故填
;在重晶石中,有氧化铁杂质,经过焦炭高温会生成单质铁,铁和盐酸反应会产生氢气,故填![]() ;
;
(4)到该步骤时,含有杂质氯化亚铁,故在不引入其他杂质的情况下除铁,加入氧化钡固体,生成氯化钡和氧化亚铁沉淀,过滤后可出去铁,故填d;判断滤液中是否有亚铁离子,滴入氢氧化钠溶液,是否产生沉淀,则可判断铁是否完全去除;故填![]() ;
;
(5)水洗为了清洗滤渣中的钡盐,防止对自然环境的污染;
(6)①根据题意可知,设定氯化钡质量为y:
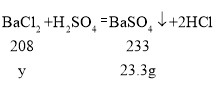 ,y=20.8g,即氯化钡为20.8g,因为称取氯化钡水合物晶体为24.4g,那么水的质量为
,y=20.8g,即氯化钡为20.8g,因为称取氯化钡水合物晶体为24.4g,那么水的质量为![]() ,
,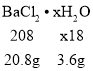 ,
,![]() ;
;
②若有部分沉淀被滤纸中的碳还原为![]() ,但是在称量过程中,会误认为沉淀物都是硫酸钡,故称量的沉淀质量会偏小,那么计算出的氯化钡质量就会偏小,同时在计算氯化钡水合物中水的质量就会偏大,计算x数值会偏高,故填偏高。
,但是在称量过程中,会误认为沉淀物都是硫酸钡,故称量的沉淀质量会偏小,那么计算出的氯化钡质量就会偏小,同时在计算氯化钡水合物中水的质量就会偏大,计算x数值会偏高,故填偏高。

 小学课时特训系列答案
小学课时特训系列答案【题目】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加.
[知识回放]
金属活动性顺序:K Ca Na Mg Al Zn Sn Pb(H) Hg Ag Pt Au,请你在横线上填写对应金属的元素符号.
[作出猜想]
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu>Cr; 猜想3.你的猜想是 .
[查阅资料]
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
[设计实验]
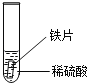
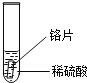
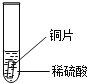
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸.
实验 | 试管1 | 试管2 | 试管3 |
实验 操作 |
|
|
|
实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 |
|
[结论与解释]
(1)小聪得到的结论是猜想 正确.
(2)实验前用砂纸打磨金属片的目的是 .
[知识运用]
将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行.若能进行,请你写出反应的化学方程式 .