题目内容
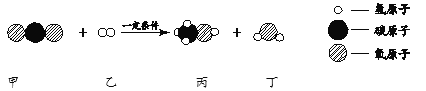
【题目】为探究酸的化学性质,进行如图实验:
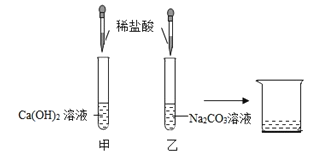
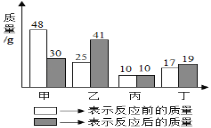
①甲实验没有观察到明显现象,乙实验现象是_____,属于中和反应的实验_____(填“甲”或“乙”)
②将反应后甲乙两试管中的溶液部分倒入烧杯中,没有观察到明显现象。由此猜想反应后乙试管中溶液的溶质只有两种可能性:
a.NaCl、HCl b. _____
(可能涉及的化学反应方程式为:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH;CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl
③为了验证猜想a,某同学对乙试管中剩余溶液,设计了如下实验方案。
方案编号 | 实验操作 | 实验现象 | 结论 |
方案1 | 取样于试管中,滴加紫色石蕊试液 | _____ | 猜想a成立 |
④下列物质代替石蕊试液,也可以达到验证目的,其中不正确的是_____(填序号).
A 铁粉 B 酚酞溶液 C 氧化铜粉末 D 氢氧化钠溶液
【答案】有气泡产生 甲 NaCl 紫色石蕊试液变红 BD
【解析】
①氢氧化钙和稀盐酸反应生成氯化钙和水,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,因此乙实验现象是产生气泡;氢氧化钙和稀盐酸反应生成氯化钙和水,属于酸和碱反应,生成盐和水,满足中和反应的特点,所以属于中和反应的实验是甲;
②将反应后甲乙两试管中的溶液部分倒入烧杯中,没有观察到明显现象,说明乙中的碳酸钠已经完全反应,这是因为如果碳酸钠过量时,能和甲中反应生成的氯化钙反应生成碳酸钙白色沉淀,由此猜想反应后乙试管中溶液的溶质可能是恰好完全反应生成的氯化钠,也可能是反应生成的氯化钠和过量的氯化氢;
③猜想a成立,则溶液中存在盐酸,盐酸能使石蕊试液变红色。验证猜想a,方案1:取样于试管中,滴加紫色石蕊试液,溶液变红色,猜想a成立;
④A 当溶液中含有稀盐酸时,加入铁粉时,产生气泡,可用铁粉代替石蕊,故A正确;
B 无论是否存在盐酸,加入无色酚酞溶液后溶液不变色,不可用酚酞代替石蕊,故B错误;
C当溶液中含有稀盐酸时,加入氧化铜粉末时,溶液由无色变成蓝色,可用氧化铜粉末代替石蕊,故C正确;
D 无论是否存在盐酸,加入氢氧化钠时后,无明显现象,不能判断溶液中是否含有稀盐酸,故D错误。故选BD。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案