题目内容
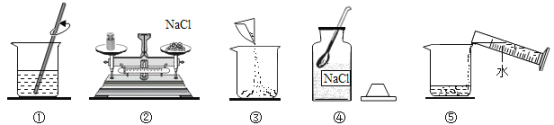
【题目】现有一定量的含ZnO的锌粒,请从图中选择适当的实验装置,设计一实验测定锌粒的纯度,可供选择的试剂有:①稀硫酸 ②稀硝酸 ③浓硫酸④硫酸铜溶液⑤浓硝酸。

请回答下列问题:
(1)写出仪器的名称:1_______,2___________,3__________;
(2)测定纯度可以设计两种方法,一种是最简单的,则选择仪器是_________(填装置编号)。戊中选择的药品是____(填编号);若气体从左向右流,则接口的顺序为__________(填接口字母代号);
(3)仪器组装好后,在开始实验时,要先_________________。
(4)若实验样品质量是10g,实验中测定氢气的体积是2.22L(氢气密度为0.09g/L)则样品的纯度约为_______。
【答案】 铁架台 长颈漏斗 试管 戊乙丙 ① H、D、C、E 检验装置气密性 65%
【解析】积求出氢气的质量,从而求出氢气的质量,利用氢气的质量求出金属锌的质量即可.
解答:(1)仪器的名称:1铁架台;2长颈漏斗;(2)锌和稀硫酸反应生成氢气,氢气难溶于水,排出水的体积就等于氢气的体积,所以测定纯度可选择仪器是戊乙丙,戊中选择的药品是稀硫酸;若气体从左向右流,则接口的顺序为H→D→C→E;(3)有气体生成的反应要先检验装置的气密性,操作方法是用手堵塞导管口向长颈漏斗中倒水,直到长颈漏斗中有液柱差,说明装置不漏气;(4)氢气的质量=2.22L×0.09g/L≈0.2g,设样品中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
652
x 0.2g
65/x=2/0.2g x=6.5g
样品的纯度=6.5g÷10g×100%=65%

练习册系列答案
相关题目