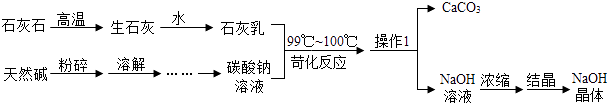
题目内容
【题目】学校课外兴趣小组的同学们为测定某生铁样品(假定其中只含单质铁和单质碳)中铁的质量分数,他们各称取10g生铁样品分别放到相同浓度、不同质量的稀硫酸中,充分反应后,分别得到如下数据:
实验次数 | 1 | 2 | 3 | 4 |
稀硫酸质量/g | 25 | 50 | 75 | 100 |
生成H2的质量/g | 0.1 | 0.2 | 0.3 | 0.3 |
(1)试计算该生铁样品中铁的质量分数。
(2)若要炼得这种生铁100 t,需要含Fe2O3 80%的赤铁矿多少吨?
【答案】(1)84% (2) 150 t
【解析】(1)根据实验数据可知,10g生铁样品与足量稀硫酸反应生成氢气的质量是0.3g,设10g生铁样品中铁的质量是x,
Fe+ H2SO4 == FeSO4 + H2↑
56 2
x 0.3g
![]() =
=![]() ,解得x= 8.4g,故生铁样品中铁的质量分数为:
,解得x= 8.4g,故生铁样品中铁的质量分数为: ![]() ×100%=84%
×100%=84%
(2)100 t生铁中铁的质量是100 t×84%=84 t,设若要炼得这种生铁100 t,需要含Fe2O3 80%的赤铁矿的质量为y,则含Fe2O3的质量为:y×80%,
Fe2O3+3CO 高温2Fe+3CO2
160 112
y×80% 84 t
![]() =
=![]() ,解得y= 150 t
,解得y= 150 t

 天天向上口算本系列答案
天天向上口算本系列答案【题目】某校化学兴趣小组就空气中氧气的含量进行实验探究:
[集体讨论]:
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体。他们应该选择(填编号)________,
A. 蜡烛 B. 红磷 C. 硫粉
为了充分消耗容器中的氧气,药品的用量应保证________________。
(2)小组同学共同设计了如下图的两套装置,你认为合理的是(填编号)________。
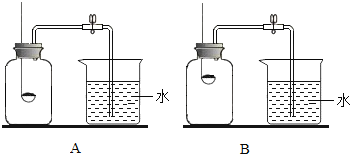
为了确保实验的成功,在装药品之前应该__________________________。
[分组实验] 在讨论的基础上,他们分组进行了实验。
[数据分析] 实验结束后,整理数据如下:(注:集气瓶容积为100mL)
组 别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中水的体积(mL) | 20 | 21 | 19 | 20 | 22 | 18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的____________。通过实验还可以推断集气瓶中剩余气体的性质是___________。
[实验拓展]
(4)小组的同学做完实验后又尝试用木炭重新做了以上实验,发现水几乎没有进入集气瓶。经讨论,同学们一致认为如果事先在集气瓶内注入少量__________溶液来吸收____________气体,实验也能取得较好的效果。