题目内容
某化肥厂需要大量二氧化碳生产化肥,欲购进一批石灰石(其中杂质不参加任何反应),厂家到产地取样分析以确定价格.他们取样2g,并把20g稀盐酸分四次加入,充分反应后.每次剩余固体质量见表:| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5g | 1.4g |
| 第二次再加入5g | 0.8g |
| 第三次再加入5g | 0.4g |
| 第四次再加入5g | 0.4g |
(1)石灰石样品中碳酸钙的质量分数是多少?
(2)1000㎏这种石灰石充分煅烧后,可得二氧化碳质量是多少?
【答案】分析:(1)根据表中三、四次的数据可知,加入盐酸时,剩余固体的质量不再减少.样品中的碳酸钙已全部参加了反应,剩余的固体是杂质,样品中的杂质为0.4g;
(2)先求出1000㎏这种石灰石中碳酸钙的质量,然后根据高温煅烧石灰石的反应求解即可.
解答:解:(1)由表中三、四次的数据可知:加入盐酸时,剩余固体的质量不再减少,样品中的碳酸钙全参加反应,剩余的固体是杂质,杂质的质量为0.4g;样品中碳酸钙的质量为2g-0.4g=1.6g.故石灰石样品中碳酸钙的质量分数是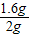 ×100%=80%;
×100%=80%;
(2)1000㎏这种石灰石中碳酸钙的质量为1000kg×80%=800kg,设生成二氧化碳的质量为x.
CaCO3 CaO+CO2↑
CaO+CO2↑
100 44
800kg x
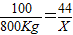 解得:x=352kg
解得:x=352kg
答:(1)石灰石样品中碳酸钙的质量分数是80%;(2)1000㎏这种石灰石充分煅烧后,可得二氧化碳质量是352Kg
点评:解答该题从表中数据分析入手,抓住什么时候碳酸钙和稀盐酸全反应是关键,计算要细心.
(2)先求出1000㎏这种石灰石中碳酸钙的质量,然后根据高温煅烧石灰石的反应求解即可.
解答:解:(1)由表中三、四次的数据可知:加入盐酸时,剩余固体的质量不再减少,样品中的碳酸钙全参加反应,剩余的固体是杂质,杂质的质量为0.4g;样品中碳酸钙的质量为2g-0.4g=1.6g.故石灰石样品中碳酸钙的质量分数是
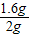 ×100%=80%;
×100%=80%;(2)1000㎏这种石灰石中碳酸钙的质量为1000kg×80%=800kg,设生成二氧化碳的质量为x.
CaCO3
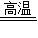 CaO+CO2↑
CaO+CO2↑100 44
800kg x
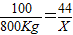 解得:x=352kg
解得:x=352kg答:(1)石灰石样品中碳酸钙的质量分数是80%;(2)1000㎏这种石灰石充分煅烧后,可得二氧化碳质量是352Kg
点评:解答该题从表中数据分析入手,抓住什么时候碳酸钙和稀盐酸全反应是关键,计算要细心.

练习册系列答案
相关题目
某化肥厂需要大量二氧化碳生产化肥,欲购进一批石灰石(其中杂质不参加任何反应),厂家到产地取样分析以确定价格.他们取样2g,并把20g稀盐酸分四次加入,充分反应后.每次剩余固体质量见表:
| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5g | 1.4g |
| 第二次再加入5g | 0.8g |
| 第三次再加入5g | 0.4g |
| 第四次再加入5g | 0.4g |
(1)石灰石样品中碳酸钙的质量分数是多少?
(2)1000㎏这种石灰石充分煅烧后,可得二氧化碳质量是多少?
(3)所用稀盐酸中氯化氢的质量分数是多少?
某化肥厂需要大量二氧化碳生产化肥,欲购进一批石灰石(其中杂质不参加任何反应),厂家到产地取样分析以确定价格.他们取样2g,并把20g稀盐酸分四次加入,充分反应后.每次剩余固体质量见表:
试计算:
(1)石灰石样品中碳酸钙的质量分数是多少?
(2)1000㎏这种石灰石充分煅烧后,可得二氧化碳质量是多少?
(3)所用稀盐酸中氯化氢的质量分数是多少?
| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5g | 1.4g |
| 第二次再加入5g | 0.8g |
| 第三次再加入5g | 0.4g |
| 第四次再加入5g | 0.4g |
(1)石灰石样品中碳酸钙的质量分数是多少?
(2)1000㎏这种石灰石充分煅烧后,可得二氧化碳质量是多少?
(3)所用稀盐酸中氯化氢的质量分数是多少?