题目内容
【题目】小明在协助老师清理实验室时,发现有一瓶碳酸钠和氯化钠组成的混合液。他想测定该溶液中碳酸钠和氯化钠的质量分数,为此设计并进行了如下实验。
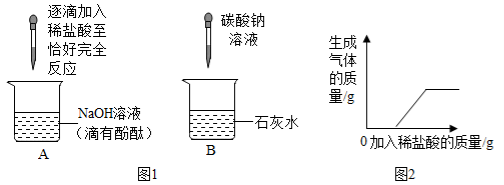
【实验1】取该混合液50 g ,向其中逐滴加入稀盐酸,当加入稀盐酸的质量为20 g、40 g、60 g 时,生成气体的质量见下表(气体的溶解度忽略不计)。
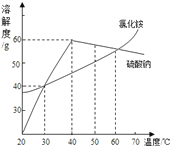
【实验2】另取该溶液50 g ,加入一定量稀盐酸充分反应后,测得溶液的pH=7,然后再加入硝酸银溶液,测得实验数据见右图。

试分析计算:
(1)【实验1】中,第二组数据 m 为 g。
(2)混合液中碳酸钠的质量分数是多少?
(3)混合液中氯化钠的质量分数是多少?(计算结果精确至0.1%)
【答案】(1)4.4(1分) (2)26.5% (3)17.5%
【解析】根据表中数据分析,第Ⅰ组加入的稀盐酸完全反应,且每20g完全反应产生二氧化碳的质量为2.2g,据此可判断m=4.4,且第Ⅲ组中盐酸过量,即样品完全反应产生气体质量为5.5g。根据二氧化碳的质量可计算出混合液中碳酸钠的质量分数,并计算出反应生成氯化钠的质量,根据反应后的混合溶液与硝酸银反应的图像可计算出反应后溶液中氯化钠的质量,将反应后溶液中氯化钠质量减去反应生成的氯化钠的质量就是原混合液中氯化钠的质量,据此可计算出原混合液中氯化钠的质量分数。
(2)解:分析数据可知50 g混合溶液中碳酸钠与盐酸完全反应生成5.5g二氧化碳,
设50 g混合溶液中碳酸钠质量为x,同时与盐酸反应生成氯化钠的质量为y。
Na2CO3+ 2HCl =" 2NaCl" + H2O + CO2↑(1分)
106 117 44
x y 5.5g
106/44=x/5.5g x=13.25g(1分)
117/44=y/5.5g y=14.63g(1分)
混合溶液中碳酸钠的质量分数:13.25g/50g×100%=26.5%(1分)
(3)设生成氯化银沉淀需要氯化钠的质量为z
NaCl + AgNO3= AgCl ↓ + NaNO3(1分)
58.5 143.5
z 57.4g
58.5/143.5=z/57.4g z=23.4g(1分)
混合溶液中氯化钠的质量分数为:(23.4g-14.63g)/50g×100%=17.5%(1分)
答:混合液中碳酸钠的质量分数为26.5%;混合液中氯化钠的质量分数为17.5%。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】化学家用![]() 与
与![]() 在高温高压、催化剂的作用下,制得了纳米级别的金刚石,同时得到一种白色固体。白色固体是什么呢?同学们对这个问题产生了兴趣,并进行了下面探究:
在高温高压、催化剂的作用下,制得了纳米级别的金刚石,同时得到一种白色固体。白色固体是什么呢?同学们对这个问题产生了兴趣,并进行了下面探究:
【提出问题】白色固体的成分是什么?
【查阅资料】
碳酸钠、氧化钠![]() 均为白色固体。
均为白色固体。
氧化钠与水在常温下反应生成氢氧化钠,化学方程式为: ![]() 。
。
③![]() 溶液呈中性,
溶液呈中性, ![]() 是不溶于水的白色固体。
是不溶于水的白色固体。
【提出猜想】甲同学:白色固体是氧化钠;乙同学:白色固体是碳酸钠;丙同学:白色固体是氧化钠和碳酸钠的混合物。
【实验与结论】
(1)甲同学为验证猜想,取白色固体样品于试管中,加适量水,滴加无色酚酞溶液,观察到酚酞溶液变红,于是得出自己的猜想正确,但遭到其他同学反对,原因是_______________。
乙、丙两位同学设计了以下方案进行验证:
实验步骤 | 实验现象 | 实验结论 |
①取少量白色固体样品于试管中,加入足量水将其溶解,并加入过量的______ | 试管中产生白色沉淀 | 白色固体中有碳酸钠 |
②往实验①反应后的试管中滴加____ | _______ | 白色固体中没有氧化钠 |
通过上述实验可证明乙同学的猜想正确,请写出金属钠与二氧化碳反应的化学方程式:_____ 。
【拓展延伸】蜡烛火焰中也含有金刚石,碳转化为金刚石的微观本质是___________。