��Ŀ����
����Ŀ���Ķ����ϣ������������
����һ:δ������������������ (Ti)������ϣ�����еĴ�����̩̹�����Ľ���,�����и������ǿ�ȣ�ȴ���������ô����;�����������ᣬ����ʴ������ǿ��ȴ�����ߵöࡣ�Ѻ�����һ����������һЩ����Ԫ���γɺϽ���ߺ���������ѧ�������������ԣ�����Ӧ��ͬ����Ҫ���ѺϽ���һ�ּ��������͵��µ����Ȿ�죬�������ִ���������������ϡ���ҵ���ڸ��º�ϡ������ı����£���þ�����Ȼ��ѷ����û���Ӧ����ȡ�ѡ������õ������Ƕ�ĺ����ѣ���Ҫ����һϵ�еļӹ����̣��ų�Ϊ��ҵ�õ��Ѳġ�
���϶�:���ò��顢 �Ҳ�������������֮�����������������ֳƷǾ�̬�Ͻ������н����Ͳ������ŵ㣬�ֿ˷������Ǹ��Եıײ����粣�����飬û����չ�ԡ�����������ǿ��ȴ���ڸ֣�Ӳ�ȳ�����Ӳ���߸֣��Ҿ���һ�������Ժ��ԡ��������еĽ�������ͨ���������̵ķ�ʽ��Ϊ�����������������ʹ�õ���һ�ֽ��Ͻ����ڳ���������Ϊ��Ҫ���ϡ�

(1)������������______________(�����ϳɲ�����������������) ;
(2)���ݲ��ϣ�д����ҵұ���ѵĻ�ѧ����ʽ__________________��
(3)�ӽ�����Դ�����ĽǶȷ�������һ�����������˷���ʴ������:����������Ҫע��ٻ��������â�_____________����Ѱ�ҽ�������Ʒ��
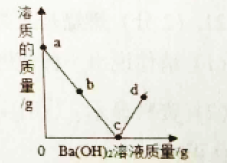
(4)��AgNO3��Cu(NO3)2�Ļ��Һ�м���һ������п�ۺ����ۣ���ַ�Ӧ����ˡ�ϴ�ӣ��õ���Һ������������˵����ȷ����________________��
A������һ����Ag,��Һ��һ����Zn(NO3)2
B����ҺΪ��ɫ����Һ��һ��û��AgNO3, һ����Zn(NO3)2��������Fe(NO3)3
C����Һ��ֻ��һ�����ʣ���������һ����Fe��Cu��Ag,������Zn
D�������м������ᣬ�����ݲ�������������һ����Zn��Fe�� Ag
���𰸡��������� 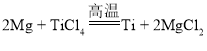 �������ɽ�����Դ AC
�������ɽ�����Դ AC
��������
��1���������������еĽ�������ͨ���������̵ķ�ʽ��Ϊ��������������֪���������Ǵ����������ڽ������ϣ�
��2�����ݲ��Ϻ������غ㶨�ɣ���ҵұ���ѵķ�Ӧ����þ�����Ȼ��ѣ����������Ѻ��Ȼ�þ����Ӧ�����Ǹ��º�ϡ�����壬��ѧ��Ӧ����ʽ 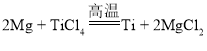
��3���ӽ�����Դ�����ĽǶȷ�������һ�����������˷���ʴ�����⣻����������Ҫע��ٻ��������á����мƻ����������ɿ�����Դ����Ѱ�ҽ�������Ʒ��
��4����Cu��NO3��2��AgNO3�Ļ��Һ�м���һ�����ĵ�п�ۺ����ۣ�п���ȷ�����Ӧ������������Ӧ��п������������Ӧ��������п��������������ͭ��Ӧ��������п��ͭ����������������Ӧ��������������������������ͭ��Ӧ��������������ͭ��
A������п���ȷ�����Ӧ��п������������Ӧ��������п������������һ����Ag����Һ��һ����Zn��NO3��2����ѡ����ȷ��
B������ҺΪ��ɫʱ����Һ��һ����������ͭ�����ܺ���AgNO3��һ����Zn��NO3��2��������Fe��NO3��3����ѡ�����
C������Һ��ֻ��һ�����ʣ�����������п����������һ����Fe��Cu��Ag��������Zn����ѡ����ȷ��
D���������м���ϡ���ᣬ�����ݲ�����˵��������ǰ�Ľ�������������һ��������������һ������п����ѡ�����ѡAC��

����Ŀ��������ʹ�ü����ع�������ɫ��������Ʒ�ʡ�ʵ��С��ͨ��ʵ���о��¶ȡ�����������3�����ضԽ�����ɫ��Ӱ�졣
���������ϣ��� ͨ��ɫ���Ǽ��L*ֵ�ɼ�ؽ�����ɫ�仯��������ɫԽ�L*ֵԽС��
�� ����ƿ���е��ص��Ǽ���ʢ�ŵ����ʺ���������롣
��ʵ������
��������Ʒ��ͬƷ�ơ�ͬ���Ρ���ʼL*ֵΪ43.82�Ľ��ͣ���װ��500 mL�IJ�ͬ�����У��ܷ⡣
������ʵ�飩
ʵ��1����װ����Ʒ�Ķ��������ƿ���ڲ�ͬ�¶ȵĺ������С�ÿ15�죬�ֱ�ȡ��δ������Ʒ����ɫ���Ǽ��L*ֵ��������¡�
��� | �¶� | 15�� | 30�� | 45�� |
1-1 | 5 �� | 43.77 | 43.53 | 42.91 |
1-2 | 28 �� | 43.71 | 43.19 | 42.85 |
1-3 | 45 �� | 43.67 | 42.55 | 40.89 |
ʵ��2����װ����Ʒ��������������28 ��ĺ������С�ÿ15�죬�ֱ�100 mL���ͣ�ʣ����Ʒ�Żغ����䡣��ɫ���Ǽ�����Ʒ��L*ֵ��������¡�
��� | ���� | 15�� | 30�� | 45�� |
2-1 | ������ƿ | 43.45 | 42.36 | 41.30 |
2-2 | ������ƿ | 43.72 | 42.98 | 42.53 |
ʵ��3����װ����Ʒ�Ķ����������28 ��ĺ������С�ÿ15�죬�ֱ�ȡ��δ������Ʒ����ɫ���Ǽ��L*ֵ��������¡�

����������ۣ�
��1��ʵ��1�ó��Ľ�����_____��
��2��ʵ��2��Ŀ����_____��
��3��ʵ��3���о����նԽ�����ɫ��Ӱ�죬Ӧѡ�õ�������_____��
��4����ͥ��ʹ��������ƿʢ�Ž��͡�����������ͬʱ���ڣ�ʹ�ù��Ľ��ͱ�δ����Ľ�����ɫ���������ݵ�ʵ����_____�����ţ���
����˼�����ۣ�
��5����ϱ�ʵ�飬���ʹ�ûؽ��͵Ľ�����_____��
��6����������������У���ʱ�������������Σ���NH4Cl��Ӱ�콴�͵ĿڸС�����̼���Ƴ�ȥ��Σ�ԭ�����£���ȫ�÷�Ӧ�Ļ�ѧ����ʽ��Na2CO3 + 2NH4Cl === 2NaCl + 2NH3�� + H2O +_____
����Ŀ����һ�������£��ס��ҡ�����������������һ�ܱ������г�ַ�Ӧ����÷�Ӧǰ������ʵ����������ʾ�����ݱ�����Ϣ�ж�����˵����ȷ����
�� �� | �� | �� | �� | �� |
��Ӧǰ������ | 2 | 30 | 20 | 10 |
��Ӧ������� | m | 39 | 5 | 16 |
A.�÷�Ӧ�ǻ��Ϸ�ӦB.��һ���Ǹ÷�Ӧ�Ĵ���
C.��Ӧ�������ҡ����仯��������Ϊ3��5D.�������ǵ���