题目内容
(4分)张南同学为了验证Na2CO3溶液中的碳酸根离子,做了如下实验。操作如下:
①向一支试管中加入约3mL的Na2CO3溶液,并滴入2滴酚酞试液,振荡试管,溶液呈均匀的红色;
②再向此试管中逐滴加入稀盐酸,至溶液颜色由红色恰好变为无色。
[提出问题]为什么向Na2CO3溶液中滴加稀盐酸不产生气泡?
[猜想与假设](提示:试剂没有问题)
①Na2CO3溶液和稀盐酸没有发生化学反应。
②Na2CO3溶液和稀盐酸发生化学反应生成的二氧化碳溶于水。
③Na2CO3溶液和稀盐酸发生化学反应生成的产物不是二氧化碳。
资料:①此Na2CO3溶液的pH 约为11,NaHCO3溶液的pH约为8;
②NaHCO3在水溶液中受热不分解;
③酚酞试液在pH≥10时的溶液为红色,在pH≤8.2时溶液为无色;
[设计方案及实验]经过讨论大家首先否定了猜想①,其理由是。
对方案②和③进行研究,决定进行如下实验,首先把上述反应后的溶液分装成3支试管。请完成下列表格。
[解释与结论]张南同学开始时的实验,即向Na2CO3溶液中滴加稀盐酸没有看到气泡的原因是(写方程式)。
[反思与应用](1)在不另取其他试剂的情况下,能够鉴别碳酸钠溶液和稀盐酸两种溶液吗?(填“能’”或“不能”)。(2)有些化学反应的产物与 有关。
[设计方案及实验]碳酸钠溶液呈碱性,能使酚酞试液变红,而加入盐酸后溶液呈无色,则溶液中不含碳酸钠,说明已与盐酸反应了。有气泡产生
[解释与结论]Na2CO3+HCl==NaHCO3+NaCl(或Na2CO3+2HCl==2NaCl+H2O+CO2↑
CO2+Na2CO3+H2O==2NaHCO3)
[反思与应用](1)能向Na2CO3溶液中滴加稀盐酸刚开始不产生气泡,而向稀盐酸中滴加Na2CO3溶液会产生气泡(或将少量的稀盐酸加入到碳酸钠溶液中不产生气泡,而将少量的碳酸钠加入到稀盐酸中会产生气泡)
(2)反应物的量
解析

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案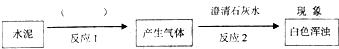

 (2011?南岗区一模)张南同学为了验证Na2CO3溶液中的碳酸根离子,做了如下实验.操作如下:①向一支试管中加入约3mL的Na2CO3溶液,并滴入2滴酚酞试液,振荡试管,溶液呈均匀的红色;②再向此试管中逐滴加入稀盐酸,边滴加边振荡,至溶液颜色由红色恰好变为无色.
(2011?南岗区一模)张南同学为了验证Na2CO3溶液中的碳酸根离子,做了如下实验.操作如下:①向一支试管中加入约3mL的Na2CO3溶液,并滴入2滴酚酞试液,振荡试管,溶液呈均匀的红色;②再向此试管中逐滴加入稀盐酸,边滴加边振荡,至溶液颜色由红色恰好变为无色.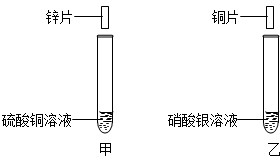 (2012?哈尔滨一模)张南同学为了验证锌、铜、银的金属活动性顺序.设计了如下实验方案:①将锌片插入到硫酸铜溶液中.如图甲;②将铜片插入到硝酸银溶液中,如图乙.根据实验①②可以判断出金属活动性强弱顺序.请回答:
(2012?哈尔滨一模)张南同学为了验证锌、铜、银的金属活动性顺序.设计了如下实验方案:①将锌片插入到硫酸铜溶液中.如图甲;②将铜片插入到硝酸银溶液中,如图乙.根据实验①②可以判断出金属活动性强弱顺序.请回答: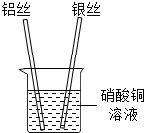 (2013?南岗区一模)张南同学为了验证铝、铜、银的金属活动性顺序,设计了如下实验方案:将铝丝、银丝分别插入到硝酸铜溶液中,如图,根据实验现象可以判断出三种金属的金属活动性强弱顺序.请回答下列问题.
(2013?南岗区一模)张南同学为了验证铝、铜、银的金属活动性顺序,设计了如下实验方案:将铝丝、银丝分别插入到硝酸铜溶液中,如图,根据实验现象可以判断出三种金属的金属活动性强弱顺序.请回答下列问题.