题目内容
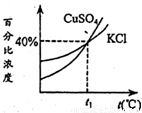
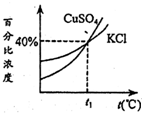
 如图是KCl、CuSO4两种物质的饱和溶液的质量百分比浓度随温度变化曲线,现分别在50g KCl和80g CuSO4固体(不含结晶水)中加水150g,加热溶解,然后分别蒸发掉50g水,冷却到t1℃,下列叙述正确的是
如图是KCl、CuSO4两种物质的饱和溶液的质量百分比浓度随温度变化曲线,现分别在50g KCl和80g CuSO4固体(不含结晶水)中加水150g,加热溶解,然后分别蒸发掉50g水,冷却到t1℃,下列叙述正确的是
- A.t1℃时,上述两种溶液中,KCl、CuSO4的溶解度相同,质量百分比浓度也相同
- B.t1℃时,析出CuSO4晶体51.4g
- C.t1℃时,溶液中KCl的质量百分比浓度小于CuSO4的质量百分比浓度
- D.t1℃时,析出氯化钾晶体的质量为10g
D
分析:硫酸铜在从溶液中析出时是以晶体的形式析出,所以可以据此结合硫酸铜与水反应生成硫酸铜晶体的化学方程式进行计算,进而作出判断即可.
解答:设蒸发掉50g水后析出的硫酸铜的质量为x,而质量为x的硫酸铜消耗水的质量为y,则:
CuSO4+5H2O═CuSO4?5H2O
160 90
x y
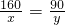
解得:y=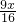
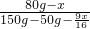 ×100%=40%
×100%=40%
解得:x=51.6g
所以此时硫酸铜溶液中含有的硫酸铜的质量为:80g-51.6g=29.4g
析出的硫酸铜晶体的质量为:51.6g+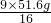 =80.6g
=80.6g
A、根据上述解答可以知道,氯化钾在温度为t1℃时的饱和溶液的质量分数为40%,而溶剂的质量为100g,所以该温度下氯化钾的溶解度为40g,但是硫酸铜的溶解度要大于40g,故A错误;
B、根据上述解答可以知道析出的硫酸铜晶体的质量为80.6g,故B错误;
C、从图中可以知道氯化钾和硫酸铜的质量百分比都为40%,故C错误;
D、根据A中的解答可以知道在温度为t1℃时氯化钾的溶解度为40g,所以若将水蒸发掉50g后,要析出氯化钾10g,故D正确.
故选D.
点评:解答这类题目时,首先,要熟记和理解溶质质量分数及其有关计算,饱和溶液和不饱和溶液的概念及其相互转变方法,以及物质的溶解和结晶的方法等相关知识;然后,根据所给图表信息,结合所学的相关知识和技能细心地进行探究、推理,最后,按照题目的要求,认真地进行选择或解答即可.
分析:硫酸铜在从溶液中析出时是以晶体的形式析出,所以可以据此结合硫酸铜与水反应生成硫酸铜晶体的化学方程式进行计算,进而作出判断即可.
解答:设蒸发掉50g水后析出的硫酸铜的质量为x,而质量为x的硫酸铜消耗水的质量为y,则:
CuSO4+5H2O═CuSO4?5H2O
160 90
x y
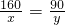
解得:y=
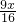
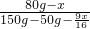 ×100%=40%
×100%=40%解得:x=51.6g
所以此时硫酸铜溶液中含有的硫酸铜的质量为:80g-51.6g=29.4g
析出的硫酸铜晶体的质量为:51.6g+
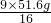 =80.6g
=80.6gA、根据上述解答可以知道,氯化钾在温度为t1℃时的饱和溶液的质量分数为40%,而溶剂的质量为100g,所以该温度下氯化钾的溶解度为40g,但是硫酸铜的溶解度要大于40g,故A错误;
B、根据上述解答可以知道析出的硫酸铜晶体的质量为80.6g,故B错误;
C、从图中可以知道氯化钾和硫酸铜的质量百分比都为40%,故C错误;
D、根据A中的解答可以知道在温度为t1℃时氯化钾的溶解度为40g,所以若将水蒸发掉50g后,要析出氯化钾10g,故D正确.
故选D.
点评:解答这类题目时,首先,要熟记和理解溶质质量分数及其有关计算,饱和溶液和不饱和溶液的概念及其相互转变方法,以及物质的溶解和结晶的方法等相关知识;然后,根据所给图表信息,结合所学的相关知识和技能细心地进行探究、推理,最后,按照题目的要求,认真地进行选择或解答即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 如图是KCl、CuSO4两种物质的饱和溶液的质量百分比浓度随温度变化曲线,现分别在50g KCl和80g CuSO4固体(不含结晶水)中加水150g,加热溶解,然后分别蒸发掉50g水,冷却到t1℃,下列叙述正确的是( )
如图是KCl、CuSO4两种物质的饱和溶液的质量百分比浓度随温度变化曲线,现分别在50g KCl和80g CuSO4固体(不含结晶水)中加水150g,加热溶解,然后分别蒸发掉50g水,冷却到t1℃,下列叙述正确的是( )