题目内容
【题目】现有失去标签的4种固体物质,分别是BaCl2、BaCO3、Na2CO3和NaHSO4。
(1)在仅提供蒸馏水和所需仪器的条件下,鉴别出上述4种固体物质。
①最先鉴别出来的固体物质是_____。
②利用①中鉴别出来的物质又可直接鉴别出的固体物质是_____,依据的实验现象是_____。
③利用②中鉴别出来的物质即可鉴别出其它物质。
(2)用鉴别出来的物质进行实验:向Na2CO3溶液中滴入BaCl2溶液至恰好完全反应。
①观察到的实验现象是_____。
②下图表示该反应前后溶液中存在的主要离子,写出以下图形代表的离子(填离子符号):
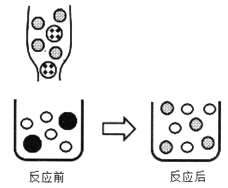
![]() _____
_____![]() _____
_____![]() _____
_____
【答案】BaCO3 NaHSO4 有气泡产生 产生白色沉淀 Cl- Na+ CO32-
【解析】
(1)①NaHSO4、Na2CO3、BaCl2、BaCO3固体四种物质中只有碳酸钡不溶于水,将四种物质分别加入水,不能形成溶液的是碳酸钡,所以最先检验出来的固体物质是碳酸钡;
②由于NaHSO4在水中会解离出Na+、H+、SO42-其中能组合成硫酸,硫酸能与碳酸钡反应生成硫酸钡沉淀、水和二氧化碳,所以有气体放出的是硫酸氢钠, 所以利用它又可直接检验出的固体物质是硫酸氢钠;
(2)①向Na2CO3溶液中滴入BaCl2溶液至恰好完全反应生成碳酸钡沉淀和氯化钠,观察到的实验现象是产生白色沉淀;
②向Na2CO3溶液中滴入BaCl2溶液至恰好完全反应生成碳酸钡沉淀和氯化钠,反应的实质是碳酸根离子与钡离子产生碳酸钡沉淀,氯离子与钠离子在反应过程中不变。![]() 表示氯化钡溶液中反应后溶液中存在的氯离子,离子符号为:Cl-;
表示氯化钡溶液中反应后溶液中存在的氯离子,离子符号为:Cl-;![]() 表示碳酸钠溶液中反应后溶液中存在的钠离子,离子符号为Na+:Na+;
表示碳酸钠溶液中反应后溶液中存在的钠离子,离子符号为Na+:Na+;![]() 碳酸钠溶液中的碳酸根离子,离子符号为:CO32-。
碳酸钠溶液中的碳酸根离子,离子符号为:CO32-。

【题目】下列反应中属于复分解反应的是
A. 3Fe + 2O2![]() Fe3O4B. 2KOH+H2SO4=K2SO4+2H2O
Fe3O4B. 2KOH+H2SO4=K2SO4+2H2O
C. H2 + CuO![]() Cu + H2OD. Fe2O3 + 3CO
Cu + H2OD. Fe2O3 + 3CO![]() 2Fe+3CO2
2Fe+3CO2
【题目】某实验小组利用石灰石残渣(杂质不溶于水也不溶于酸)制备轻质CaCO3,同时得到K2SO4,其工艺流程简要如下:
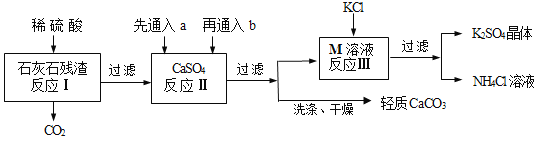
已知:CaCO3 + H2O + CO2 = Ca(HCO3)2
(1)为了提高反应Ⅰ的速率,下列措施中可行的是____(填序号);
①搅拌 ②将残渣粉碎成细小颗粒 ③适当增大硫酸的浓度
(2)反应Ⅱ中a和b分别是____(填序号);
①足量CO2、适量NH3 ②足量NH3、适量CO2
③适量CO2、足量NH3 ④适量NH3、足量CO2
(3)反应Ⅲ中相关物质的溶解度如下表,该表中M物质的化学式为____,反应Ⅲ在常温下能实现的原因是____,生成的NH4Cl溶液在农业上可用作____;
物 质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)将得到的轻质CaCO3进行洗涤,判断CaCO3固体已洗涤干净的方法:取最后一次洗涤液,____(填序号),若无明显的现象,则已洗净;
①滴加稀盐酸
②滴加Na2SO4 溶液
③滴加BaCl2溶液
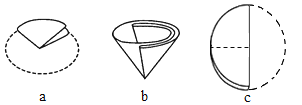
(5)过滤器中的滤纸折叠方法如图所示,正确的顺序是____(填序号);
(6)该工艺流程中可循环利用的物质除H2O外,还有____。