题目内容
【题目】请根据下列装置,回答问题:
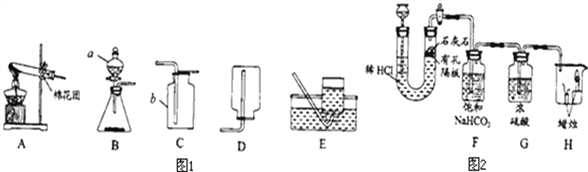
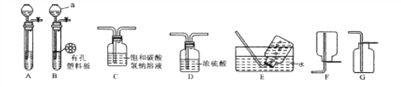
(1)写出图1中有标号仪器的名称: b______.
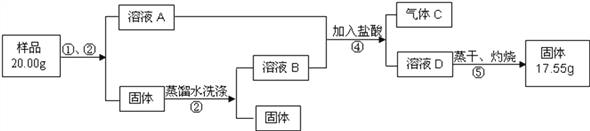
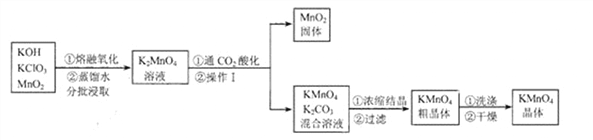
(2)①用高锰酸钾制取一瓶氧气,可选用装置A和______(选填序号)组合.装入药品前要先______;实验所用高锰酸钾工业上可用高纯度的二氧化锰为原料制取,主要流程如下:
已知相关物质的溶解度(20℃)如下表:

②流程里K2MnO4中锰元素的化合价为__________。
③操作I的名称是_____。“干燥”过程中温度不宜过高的原因是_________________(用化学方程式表示)。
④“通CO2酸化”,反应的化学方程式为: 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3 若用稀H2SO4酸化,反应的化学方程式为: 3K2MnO4+2H2SO4=2KMnO4 +MnO2↓+2K2SO4+2H2O 工业上不采用稀H2SO4酸化的原因是____________________。
⑤电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为:![]() 与“通CO2酸化”相比,其优点是___________。
与“通CO2酸化”相比,其优点是___________。
(3)用双氧水和二氧化锰制氧气,二氧化锰的作用是____,可选用的发生装置是____(填序号)。
(4)用如图2装置制取CO2并验证相关性质。
①生成CO2反应的化学方程式_________,该反应属_______反应(写基本反应类型);
②F装置的作用是______;
③H装置中的现象可说明CO2具有的性质是______(答一点即可)。
【答案】 集气瓶 C 或 E 检查装置气密性 +6 过滤 2KMnO4![]() K2MnO4+MnO2+O2↑ 相同条件下硫酸钾和高锰酸钾溶解度都比较小无法采用浓缩结晶的方法分离 生成的氢氧化钾可以循环使用、转化率高没有锰元素损失或锰元素利用率高 催化作用 B CaCO3+2HCl=CaCl2+H2O+CO2↑ 复分解反应 吸除二氧化碳中的氯化氢气体 二氧化碳不能燃烧、不能支持燃烧、密度比空气大
K2MnO4+MnO2+O2↑ 相同条件下硫酸钾和高锰酸钾溶解度都比较小无法采用浓缩结晶的方法分离 生成的氢氧化钾可以循环使用、转化率高没有锰元素损失或锰元素利用率高 催化作用 B CaCO3+2HCl=CaCl2+H2O+CO2↑ 复分解反应 吸除二氧化碳中的氯化氢气体 二氧化碳不能燃烧、不能支持燃烧、密度比空气大
【解析】(1)图1中有标号仪器的名称: b:集气瓶;(2)①氧气的密度比空气大,可用向上排空气法收集,选择装置C;氧气难溶于水,也可以选择排水集气法的装置E,所以用高锰酸钾制取一瓶氧气,可选用装置A和C 或 E组合.装入药品前要先检查装置气密性;②化合物中元素的化合价代数和为零,钾元素显+1价,氧元素显-2价,K2MnO4中锰元素的化合价为+6;③操作I的目的是将难溶性固体与液体分离,名称是过滤。“干燥”过程中温度不宜过高的原因是高锰酸钾加热条件下会分解,反应方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;④由题中信息可知,用硫酸酸化会生成硫酸钾,相同条件下硫酸钾和高锰酸钾溶解度都比较小无法采用浓缩结晶的方法分离,故工业上不采用稀H2SO4酸化; ⑤由题中信息可知,电解法生成的氢氧化钾可以循环使用、转化率高、没有锰元素损失或锰元素利用率高 (3)用双氧水和二氧化锰制氧气,二氧化锰的作用是催化作用(或加快过氧化氢分解速率),可选用的发生装置是固液常温型B;(4)①石灰石的主要成分是碳酸钙,和稀盐酸反应生成二氧化碳、氯化钙和水,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,该反应属复分解反应;②盐酸有挥发性,挥发出来的氯化氢气体混在二氧化碳中,导致收集二氧化碳不纯,碳酸氢钠和盐酸反应生成二氧化碳,所以F装置的作用是吸除二氧化碳中的氯化氢气体;③H装置中的现象是蜡烛由低到高依次熄灭,可说明CO2具有的性质是二氧化碳不能燃烧、不支持燃烧、密度比空气大。
K2MnO4+MnO2+O2↑;④由题中信息可知,用硫酸酸化会生成硫酸钾,相同条件下硫酸钾和高锰酸钾溶解度都比较小无法采用浓缩结晶的方法分离,故工业上不采用稀H2SO4酸化; ⑤由题中信息可知,电解法生成的氢氧化钾可以循环使用、转化率高、没有锰元素损失或锰元素利用率高 (3)用双氧水和二氧化锰制氧气,二氧化锰的作用是催化作用(或加快过氧化氢分解速率),可选用的发生装置是固液常温型B;(4)①石灰石的主要成分是碳酸钙,和稀盐酸反应生成二氧化碳、氯化钙和水,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,该反应属复分解反应;②盐酸有挥发性,挥发出来的氯化氢气体混在二氧化碳中,导致收集二氧化碳不纯,碳酸氢钠和盐酸反应生成二氧化碳,所以F装置的作用是吸除二氧化碳中的氯化氢气体;③H装置中的现象是蜡烛由低到高依次熄灭,可说明CO2具有的性质是二氧化碳不能燃烧、不支持燃烧、密度比空气大。

 口算能手系列答案
口算能手系列答案【题目】根据下图从A或B两题中任选一个作答,若两题均作答,按A计分。
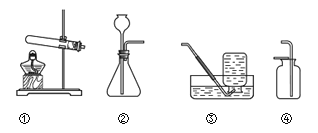
A | B |
(1)选用装置①制氧气的化学方程式为____________。 (2)选用装置③收集氧气的理由为____________。 | (1)选用装置②制二氧化碳的化学方程式为___________。 (2)选用装置④收集二氧化碳时,检验气体是否集满的操作是___________。 |
【题目】某化学课外小组的同学,在实验室发现四瓶标签破损的无色溶液(如下图所示),其中A、B试剂瓶标签部分破损,C、D试剂瓶标签完全破损。根据查阅药品记录表可知,A、B、C、D分别是NaOH溶液、Na2CO3溶液、石灰水、CaCl2溶液中的一种。
在老师的指导下,化学课外小组同学进行了下述实验。
老师给准备的试剂有:稀盐酸、NaHCO3溶液和酚酞溶液。
(1)分别取A、B、C、D溶液于4支试管中,向其中分别滴加酚酞溶液,发现A、B、C溶液变红,说明这3种溶液呈__________ (填“酸性”、“碱性”或“中性”)。由该实验可确定的溶液为___________ (填试剂瓶序号及相应的溶液名称)。
(2)分别取A、B溶液于两支试管中,加入足量的稀盐酸,发现均有气泡产生,小组同学利用上述共计7种试剂,经过下述实验最终确定了这两份溶液的成分。
实验操作 | 现象 | 实验结论 |
①分别取A、B溶液于2支试管中,向其中分别滴加_________; ②过滤后,分别向滤液中滴加______。 | 白色沉淀 A:___________ B:___________ | A是Na2CO3溶液; B是变质的NaOH溶液 |
写出B溶液中加入足量的稀盐酸发生反应的化学方程式 ___________________。
(3)取C溶液于试管中,逐滴加入一定量的NaHCO3溶液,充分反应,观察到溶液变浑浊,过滤,滤液中除了H外,还含有较大量的阳离子是_________(填离子符号)查阅资料可知:Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O、NaOH+ NaHCO3=Na2CO3+H2O