题目内容
【题目】人类的生存和发展离不开能源和资源。
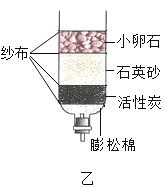
(1)某同学用下图所示装置探究可燃物燃烧的条件,下列结论中正确的是_____(选填字母)。

A图1中的热水只起到提高温度的作用
B图2中的白磷换成红磷也会有同样的现象
C图1中的实验可以比较红磷和白磷着火点的高低
D该实验主要利用了铜片良好的导热性,燃着的白磷熄灭后,去掉铜片上的白色固体可以看到铜片表面变黑
(2)乙醇属于_____(填“可”或“不可”)再生资源,写出乙醇燃烧的化学方程式_____。
(3)已知:在相同的温度和压强下,相同体积的气体具有相同的分子数,反之亦然。取20℃和![]() 下体积比为1:3的甲烷和O2混合,在一定条件下充分反应,恢复到初始温度和压强,则生成的CO2分子个数与原来的气体分子数之比为_____。在我们的日常生活中用到的燃气有液化石油气和天然气等,液化石油气的主要成分含有丙烷(
下体积比为1:3的甲烷和O2混合,在一定条件下充分反应,恢复到初始温度和压强,则生成的CO2分子个数与原来的气体分子数之比为_____。在我们的日常生活中用到的燃气有液化石油气和天然气等,液化石油气的主要成分含有丙烷(![]() ),原本以液化石油气为燃料的家庭若要改用天然气,灶具的改进方法可以是_____(选填字母)。
),原本以液化石油气为燃料的家庭若要改用天然气,灶具的改进方法可以是_____(选填字母)。
A减小空气的进入量
B增大天然气的进入量
C增大空气的进入量
D减小天然气的进入量
(4)氢气是最清洁的能源。某同学用电解器电解水时,在水中加少许硫酸钠增强其导电性,通电一段时间后,发现正极上产生3.2g气体。用化学方程式计算电解掉的水的质量为多少?(在答题卡上写出计算过程)_____。
【答案】CD 可 C2H5OH+3O2![]() 2CO2+3H2O 1:4 AB 3.6g
2CO2+3H2O 1:4 AB 3.6g
【解析】
(1)A.烧杯中的热水,除了给可燃物加热外,还能够使可燃物--白磷与氧气隔绝,故错误;
B.红磷的着火点在200℃以上,热水的温度达不到红磷的着火点,红磷不燃烧,故错误;
C.铜片上的白磷、红磷都和氧气接触,温度也相同,然而白磷燃烧、红磷不燃烧,说明可燃物燃烧要达到着火点,可以比较二者的着火点,故正确;
D.该实验主要利用了铜片良好的导热性,燃着的白磷熄灭后,去掉铜片上的白色固体可以看到铜片表面变黑,故正确。
故选:CD。
(2)乙醇可利用植物的种子或果实经发酵制得,乙醇属于可再生资源,乙醇完全燃烧生成二氧化碳和水,反应的化学方程式为:C2H5OH+3O2![]() 2CO2+3H2O.故填:可;C2H5OH+3O2
2CO2+3H2O.故填:可;C2H5OH+3O2![]() 2CO2+3H2O.
2CO2+3H2O.
(3)则根据化学方程式CH4+2O2![]() CO2+2H2O可知,参加反应的甲烷和氧气的分子个数和生成的二氧化碳分子个数比1:2:1。生成的CO2分子个数为一个分子,而原气体为4个分子,所以为原来气体分子数的四分之一;)①相同情况下,气体体积相同所含分子数相同;根据反应的化学方程式,相同分子即同体积的天然气、液化石油气完全燃烧,液化石油气需要更多的氧气;为确保甲烷完全燃烧所需要的氧气量充分,需要减少空气的进入量,增大天然气的进入量;故填:1:4;AB;
CO2+2H2O可知,参加反应的甲烷和氧气的分子个数和生成的二氧化碳分子个数比1:2:1。生成的CO2分子个数为一个分子,而原气体为4个分子,所以为原来气体分子数的四分之一;)①相同情况下,气体体积相同所含分子数相同;根据反应的化学方程式,相同分子即同体积的天然气、液化石油气完全燃烧,液化石油气需要更多的氧气;为确保甲烷完全燃烧所需要的氧气量充分,需要减少空气的进入量,增大天然气的进入量;故填:1:4;AB;
(4)电解水实验,正极生成的是氧气,故生成氧气的质量为3.2g,
设电解掉的水的质量为x

x=3.6g
答:电解掉的水的质量为3.6g。
故填:3.6g。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
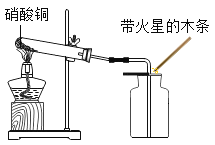
新黄冈兵法密卷系列答案【题目】同学们在研究氧气性质时,进行了如图1的实验;取一段打磨好的螺旋状铁丝,在下端系一根火柴,点燃火柴,待火柴快燃尽时,插入充满氧气且放有少量水的集气瓶中,观察到如下现象:
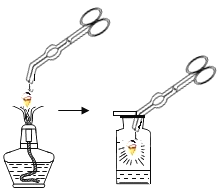
银白色的铁丝在氧气中剧烈燃烧,________,放出大量的热,生成黑色固体物质。该实验说明铁丝能够在氧气中燃烧,氧气具有助燃性。
小明在阅读相关资料时发现二氧化氮也具有助燃性,他决定利用如下实验进行探究。
(提出问题)二氧化氮是否具有助燃性?
(查阅资料)
①蓝色的硝酸铜固体在加热条件下分解生成氧化铜、二氧化氮和氧气。
②氧化铜是一种黑色固体,通常状况下,二氧化氮是一种红棕色气体,相同状况下,其密度大于氧气密度,在低于室温时变成液态。
(实验过程)
实验装置 | 实验现象 | 实验结论 |
| 试管内蓝色固体逐渐变为黑色,有红棕色气体生成,________。 | 二氧化氮具有助燃性。 |
(反思与评价)
小刚认为小明的实验不能证明![]() 具有助燃性,其理由是________.
具有助燃性,其理由是________.
小刚认为利用补充如下实验可以证明![]() 具有助燃性.
具有助燃性.
实验操作 | 实验现象 | 实验结论 |
步骤I:在上图的试管和集气瓶之间连上如图所示的装置,重新进行加热硝酸铜的实验
| 带火星的木条复燃。 | 硝酸铜分解产物中有________。 |
步骤II:取出图中的U型管,恢复至室温,待U型管内充满红棕色气体时,将带火星的木条伸入U型管中。 | 带火星的木条复燃。 |
|
小红认为即使不进行小刚的实验,依据资料和小明的实验现象也能推出![]() 具有助燃性,其理由是________。
具有助燃性,其理由是________。
【题目】(7分)化学是在原子、分子水平上研究物质及其变化的科学。
(1)现有下列化学式或微粒符号:①2CO、②Ca2+、③2H、④O2。其中,“2”表示2个分子的是 (填序号,下同),表示每个微粒带2个单位电荷的是_______。
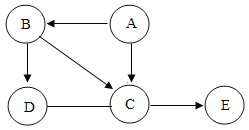
(2)一定条件下,甲和乙反应生成丙和丁(四种物质均由分子构成),反应前后微观示意图如下。下列说法正确的是 (填选项)。
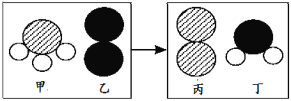
A 反应前后共有4种原子 B 该反应有单质生成
C 反应前后元素化合价都不变 D 化学变化中分子和原子均可再分
E.该化学反应中,甲、丁两种分子的个数比是2∶3
(3)胃酸过多须服用抗酸药。下表为两种抗酸药的有效成分及其构成微粒:
抗胃酸药 | 复方氢氧化镁片剂 | 铝碳酸镁片 |
有效成分 | Mg(OH)2 | AlMg(OH)3CO3 |
构成微粒 | Mg2+、OH— | Al3+、Mg2+、OH-、CO32- |
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异。
①Mg(OH)2起抗酸作用的微粒是 (填微粒符号,下同)。
②铝碳酸镁与盐酸的反应为:AlMg(OH)3CO3+5HCl=MgCl2+AlCl3+4H2O+CO2↑。则
铝碳酸镁起抗酸作用的两种微粒是 、 。