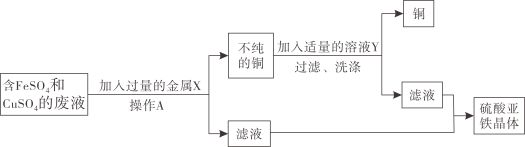
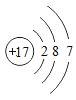
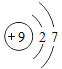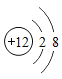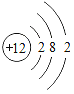题目内容
【题目】小红同学在网店花200元买了一个10g的手镯(银锌合金),她想探究此手镯中银的含量,于是请化学老师和她一起探究,在实验室用足量的稀硫酸分多次与手镯反应,记录数据如下表:
稀硫酸/g | 10 | 10 | 10 | 10 | 10 |
剩余固体质量/g | 8.7 | 7.4 | 6.1 | 4.8 | 4.8 |
不考虑实验过程中的质量损失,请根据实验数据完成下列问题:
(1)如果小红用所得银制作一枚戒指,其质量不超过__________g。
(2)计算所用稀硫酸中溶质的质量分数?_____(计算结果精确至0.1%)
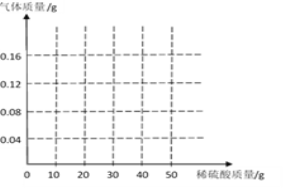
(3)请画出生成气体的质量与稀硫酸质量的关系图:________
【答案】4.8 19.6% 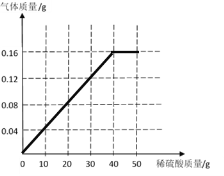
【解析】
(1)比较第四次和第五次的数据可以知道,剩余固体的质量都为4.8g,可以说明该固体中银的质量4.8g,小红用所得的银制作一枚戒指,其质量不超过4.8g;
(2)设:10g稀硫酸中H2SO4的质量为x 。
根据表格中的数据可知:10g硫酸与(10g-8.7g)=1.3g锌恰好完全反应。
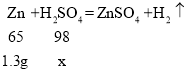
![]()
解得x=1.96g
稀硫酸中溶质的质量分数=![]() ;
;
答:稀硫酸中溶质的质量分数为19.6%.
(3)根据表格中的数据可知:银锌合金中锌的质量=10g-4.8g=5.2g;
设:5.2g的锌能产生氢气的质量为y,消耗的硫酸为z。

![]() y=0.16g
y=0.16g
![]() z=7.84g;消耗的硫酸溶液的质量=7.84g÷19.6%=40g。生成气体的质量与稀硫酸质量的关系为:
z=7.84g;消耗的硫酸溶液的质量=7.84g÷19.6%=40g。生成气体的质量与稀硫酸质量的关系为:
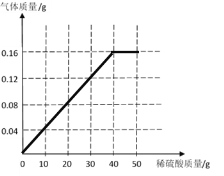 。
。

【题目】下表是氯化铵固体在不同温度下的溶解度
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 | 65.6 |
①向100 g水中不断加入氯化铵固体或改变温度,得到下图相应的溶液A~E。
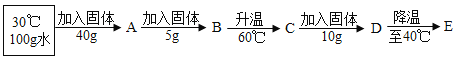
溶液D是_____ (填“ 饱和”或“不饱和”)溶液,溶液E中析出晶体__g。
②将盛有溶液E的小烧杯放入盛有水的大烧杯中,向大烧杯内加入NaOH固体,小烧杯内的固体溶解,原因是______。
【题目】下列物质中的杂质![]() 括号内是杂质
括号内是杂质![]() ,下列操作方法正确的是( )
,下列操作方法正确的是( )
选项 | 物质 | 操作方法 |
A | CO2(CO) | 点燃 |
B | CaO | 加足量的水,充分搅拌后过滤 |
C | NaOH溶液 | 通入过量 |
D | Fe(Fe2O3) | 高温条件下通入足量的CO |
A.AB.BC.CD.D