题目内容
(2008?濠江区模拟)把25g不纯的碳酸钾固体(其中杂质不溶于水,也不与稀盐酸反应)放入79.3g水中,充分搅拌,使固体中的碳酸钾完全溶解,过滤,取10g滤液放入烧杯中,向烧杯中连续四次加入稀盐酸,使其充分反应,记录每次加入的稀盐酸质量和称量每次反应后烧杯中物质的质量(假设产生的气体全部逸出烧杯),实验数据记录如下:
根据以上的信息,解答下列问题:
(1)
(2)计算稀盐酸中溶质的质量分数.(计算结果精确到0.1%)
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 每次加入稀盐酸的质量(g) | 4 | 4 | 4 | 4 |
| 每次反应后烧杯中物质的质量(g) | 13.78 | 17.56 | 21.34 | 25.34 |
(1)
12
12
g稀盐酸恰好与10g滤液中的溶质完全反应,生成气体的质量0.66
0.66
g.(2)计算稀盐酸中溶质的质量分数.(计算结果精确到0.1%)
分析:(1)根据质量守恒定律可知,第一次放出二氧化碳的质量=10g+4g-13.78g=0.22g,说明每加入4g盐酸,放出二氧化碳的质量为0.22g.第二次放出二氧化碳的质量=13.78g+4g-17.56g=0.22g,说明盐酸全部反应,第三次放出二氧化碳的质量=17.56g+4g-21.34g=0.22g,说明盐酸全部反应,而第四次没有二氧化碳放出进行解答;
(2)根据二氧化碳的质量可以求出稀盐酸中溶质的质量分数进行解答.
(2)根据二氧化碳的质量可以求出稀盐酸中溶质的质量分数进行解答.
解答:解:(1)根据质量守恒定律可知,第一次放出二氧化碳的质量=10g+4g-13.78g=0.22g,说明每加入4g盐酸,放出二氧化碳的质量为0.22g.第二次放出二氧化碳的质量=13.78g+4g-17.56g=0.22g,说明盐酸全部反应,第三次放出二氧化碳的质量=17.56g+4g-21.34g=0.22g,说明盐酸全部反应,而第四次没有二氧化碳放出,所以12g稀盐酸恰好与10g滤液中的溶质完全反应,生成气体的质量=0.22g×3=0.66g;
(2)设12g稀盐酸中溶质的质量为x
K2CO3+2HCl═2KCl+H2O+CO2↑
73 44
x 0.66g
=
解得:x=1.095g
稀盐酸中溶质的质量分数=
×100%=9.1%
答:稀盐酸中溶质的质量分数为9.1%.
(2)设12g稀盐酸中溶质的质量为x
K2CO3+2HCl═2KCl+H2O+CO2↑
73 44
x 0.66g
| 73 |
| x |
| 44 |
| 0.66g |
解得:x=1.095g
稀盐酸中溶质的质量分数=
| 1.095g |
| 12g |
答:稀盐酸中溶质的质量分数为9.1%.
点评:掌握化学方程式的计算格式和规范性,学会分析表格并从中得到一些信息的方法.

练习册系列答案
相关题目
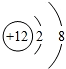 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( )