题目内容
 (1)请在H、O、N、Ca、Cl、Na这6种元素中选择恰当的元素,按要求填空:
(1)请在H、O、N、Ca、Cl、Na这6种元素中选择恰当的元素,按要求填空:
①一种重要化工产品,能使湿润的红色石蕊试纸变蓝的气体是______;
②海水中含量最高的盐中的阴离子的离子符号是______;
③可用作食品干燥剂的氧化物中的各元素的质量比是______.
(2)用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示.当加入熟石灰m g时,溶液中的溶质为______.若改用n g氢氧化钠与相同量盐酸反应,所得溶液的pH______7(填“>”、“<”或“=”).
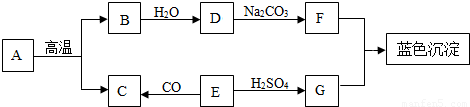
(3)A-G是初中常见的物质.其中E为黑色固体.下图为这些物质的转化关系图,其中部分生成物和反应条件已省略.

①物质C由______构成,物质G的中的阳离子符号为______.
②化学反应常伴有能量变化.B与水反应时会______(“吸收”或“放出”)热量.
③实验室 不用A与稀硫酸反应来制取C,原因是______.
④写出D→F的化学方程式______.
解:(1)氨气是一种重要化工产品,能使湿润的红色石蕊试纸变蓝的气体,其化学式为:NH3.
海水中含量最高的盐是氯化钠,氯化钠中的阴离子是氯离子,其离子符号为:Cl-.
氧化钙属于氧化物,能与水反应,可用作食品干燥剂,其中的钙元素和氧元素的质量比是40:16=5:2.
(2)当加入熟石灰mg时,pH小于7,溶液显酸性,盐酸有剩余,溶液中的溶质是盐酸中的氯化氢和反应生成的氯化钙.
由Ca(OH)2+2HCl=CaCl2+2H20;NaOH+HCl═NaCl+H2O 可知,氢氧化钙和盐酸反应的质量比是74:73,氢氧化钠和盐酸反应的质量比是80:73,加入ng氢氧化钙恰好完全反应,溶液显中性;加入ng氢氧化钠不能把盐酸反应完,即盐酸过量,溶液显酸性,PH<7.
(3)E是黑色固体,能与硫酸反应生成G,且G能与F反应生成蓝色沉淀,则G是硫酸铜,F是氢氧化钠,E是氧化铜,氧化铜能与一氧化碳反应生成C,则C可能是二氧化碳,A能高温反应生成B和二氧化碳,则A是碳酸钙,B是氧化钙,氧化钙能与水反应生成氢氧化钙,代入框图,推断合理.
①根据推断,C是二氧化碳,二氧化碳是哟二氧化碳分子构成的;物质G是硫酸铜,硫酸铜是由铜离子和硫酸根离子构成的,则阳离子是铜离子,其离子符号为:Cu2+.
②氧化钙与水反应会放出大量的热.
③稀硫酸与碳酸钙反应生成的硫酸钙是一种微溶于水的物质,覆盖在碳酸钙的表面,会阻止反应的进行.
④氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
故答案为:(1)NH3; Cl-;5:2.(2)CaCl2、HCl;<.(3)①二氧化碳分子;Cu2+.②放热.③反应不能持续进行.④Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
分析:(1)首先根据题意确定物质的化学名称,然后根据题目所提供的元素、书写化学符号的方法和步骤写出相应的化学符号即可.
(2)当加入熟石灰mg时,pH小于7,据此进行分析解答;由反应的化学方程式,可以确定物质间的质量关系,从而得知所得溶液的酸碱性.
(3)根据题干提供的信息进行分析,E是黑色固体,能与硫酸反应生成G,且G能与F反应生成蓝色沉淀,则G是硫酸铜,F是氢氧化钠,E是氧化铜;氧化铜能与一氧化碳反应生成C,则C可能是二氧化碳,A能高温反应生成B和二氧化碳,则A是碳酸钙,B是氧化钙,氧化钙能与水反应生成氢氧化钙.
点评:本题难度不大,但综合性较强,考查的知识点较多,掌握化学符号的书写方法、置中和反应应用、抓住推断题的突破口(突破口往往是现象特征、反应特征等)等是正确解答本题的关键.
海水中含量最高的盐是氯化钠,氯化钠中的阴离子是氯离子,其离子符号为:Cl-.
氧化钙属于氧化物,能与水反应,可用作食品干燥剂,其中的钙元素和氧元素的质量比是40:16=5:2.
(2)当加入熟石灰mg时,pH小于7,溶液显酸性,盐酸有剩余,溶液中的溶质是盐酸中的氯化氢和反应生成的氯化钙.
由Ca(OH)2+2HCl=CaCl2+2H20;NaOH+HCl═NaCl+H2O 可知,氢氧化钙和盐酸反应的质量比是74:73,氢氧化钠和盐酸反应的质量比是80:73,加入ng氢氧化钙恰好完全反应,溶液显中性;加入ng氢氧化钠不能把盐酸反应完,即盐酸过量,溶液显酸性,PH<7.
(3)E是黑色固体,能与硫酸反应生成G,且G能与F反应生成蓝色沉淀,则G是硫酸铜,F是氢氧化钠,E是氧化铜,氧化铜能与一氧化碳反应生成C,则C可能是二氧化碳,A能高温反应生成B和二氧化碳,则A是碳酸钙,B是氧化钙,氧化钙能与水反应生成氢氧化钙,代入框图,推断合理.
①根据推断,C是二氧化碳,二氧化碳是哟二氧化碳分子构成的;物质G是硫酸铜,硫酸铜是由铜离子和硫酸根离子构成的,则阳离子是铜离子,其离子符号为:Cu2+.
②氧化钙与水反应会放出大量的热.
③稀硫酸与碳酸钙反应生成的硫酸钙是一种微溶于水的物质,覆盖在碳酸钙的表面,会阻止反应的进行.
④氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
故答案为:(1)NH3; Cl-;5:2.(2)CaCl2、HCl;<.(3)①二氧化碳分子;Cu2+.②放热.③反应不能持续进行.④Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
分析:(1)首先根据题意确定物质的化学名称,然后根据题目所提供的元素、书写化学符号的方法和步骤写出相应的化学符号即可.
(2)当加入熟石灰mg时,pH小于7,据此进行分析解答;由反应的化学方程式,可以确定物质间的质量关系,从而得知所得溶液的酸碱性.
(3)根据题干提供的信息进行分析,E是黑色固体,能与硫酸反应生成G,且G能与F反应生成蓝色沉淀,则G是硫酸铜,F是氢氧化钠,E是氧化铜;氧化铜能与一氧化碳反应生成C,则C可能是二氧化碳,A能高温反应生成B和二氧化碳,则A是碳酸钙,B是氧化钙,氧化钙能与水反应生成氢氧化钙.
点评:本题难度不大,但综合性较强,考查的知识点较多,掌握化学符号的书写方法、置中和反应应用、抓住推断题的突破口(突破口往往是现象特征、反应特征等)等是正确解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (1)请在H、O、N、Ca、Cl、Na这6种元素中选择恰当的元素,按要求填空:
(1)请在H、O、N、Ca、Cl、Na这6种元素中选择恰当的元素,按要求填空: