题目内容
 人类对金属的开发和利用是循序渐进的.
人类对金属的开发和利用是循序渐进的.(1)青铜器是人类较早使用的金属制品.西汉时期,人们主要采用“湿法冶金”.如将铁浸入硫酸铜溶液中,该反应的化学方程式为
Fe+CuSO4═FeSO4+Cu
Fe+CuSO4═FeSO4+Cu
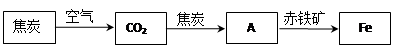
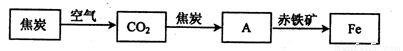
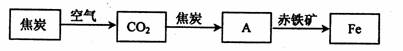
.(2)随着技术的不断进步,人们能利用还原剂从金属的氧化物中将其还原出来.例如,高炉炼铁所涉及的物质转化过程如下:

其中,物质A为
CO
CO
(填化学式),A与赤铁矿中的氧化铁反应的化学方程式为Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(3)每年因为腐蚀(如铁生锈)而报废的金属相当于年产量的20%~40%,人们采用多种方法防止金属腐蚀.例如,将清洗后的铁锅擦干后存放可以防止铁锅生锈,其原因是
防止铁与水接触
防止铁与水接触
.(4)铝的金属活动性比铁
强
强
(填“强”或“弱”),但铝制品却具有比较好的抗腐蚀性能,其原因是铝与空气中的氧气反应:4Al+3O2═2Al2O3,生成一层致密的氧化铝薄膜
铝与空气中的氧气反应:4Al+3O2═2Al2O3,生成一层致密的氧化铝薄膜
(用必要的文字和化学方程式说明).分析:(1)依据湿法炼铜的原理分析解答即可;
(2)根据炼铁的过程及原理进行分析解答即可;
(3)依据钢铁生锈的条件判断防锈的方法即可;
(4)依据金属活动性顺序的应用以及铝的化学性质分析解答;
(2)根据炼铁的过程及原理进行分析解答即可;
(3)依据钢铁生锈的条件判断防锈的方法即可;
(4)依据金属活动性顺序的应用以及铝的化学性质分析解答;
解答:解:(1)依据湿法炼铜的原理可知铁能够置换出硫酸铜中的铜,方程式为:Fe+CuSO4═FeSO4+Cu;
(2)二氧化碳在高温的条件下可以碳反应生成一氧化碳,而一氧化碳可与氧化铁反应生成铁和二氧化碳,炼铁的方程式为Fe2O3+3CO
2Fe+3CO2;
(3)钢铁生锈的条件是与水和氧气接触,故将清洗后的铁锅擦干可以防止铁与水接触,从而达到铁锅防锈的目的;
(4)依据金属活动性顺序可知铝的活动性比铁强,由于铝能与空气中的氧气生成氧化铝并附着在铝的表面,从而阻止了铝的进一步氧化,涉及到的反应方程式为:4Al+3O2═2Al2O3;
故答案为:(1)Fe+CuSO4═FeSO4+Cu;(2)CO;Fe2O3+3CO
2Fe+3CO2;(3)防止铁与水接触;(4)强; 铝与空气中的氧气反应:4Al+3O2═2Al2O3,生成一层致密的氧化铝薄膜;
(2)二氧化碳在高温的条件下可以碳反应生成一氧化碳,而一氧化碳可与氧化铁反应生成铁和二氧化碳,炼铁的方程式为Fe2O3+3CO
| ||
(3)钢铁生锈的条件是与水和氧气接触,故将清洗后的铁锅擦干可以防止铁与水接触,从而达到铁锅防锈的目的;
(4)依据金属活动性顺序可知铝的活动性比铁强,由于铝能与空气中的氧气生成氧化铝并附着在铝的表面,从而阻止了铝的进一步氧化,涉及到的反应方程式为:4Al+3O2═2Al2O3;
故答案为:(1)Fe+CuSO4═FeSO4+Cu;(2)CO;Fe2O3+3CO
| ||
点评:本题是一道金属知识的考查题,从金属的利用,冶炼,锈蚀及保存等方面全面考查了金属的性质,是一道不错的试题.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目