题目内容
(09潍坊)海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质。
I .海水提溴。从海水中提取的溴约占世界溴产量的 ,工业上常用“吹出法”制溴,其工艺流程如下:
,工业上常用“吹出法”制溴,其工艺流程如下:

试回答:
(1)步骤②中的化学方程式为2NaBr+C12=2NaCl+Br2,其反应类型是 ,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:C12+2KBr=2KCl+Br2 Br2+2KI=2KBr2+I2
由此可判断C12、I2、Br2活动性由强到弱顺序是_______。
Ⅱ .食盐制碱。我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水。
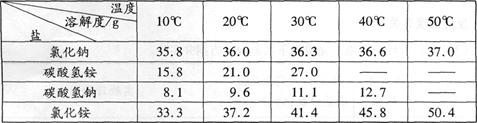
四种盐在不同温度下的溶解度表:
请回答:
(1)碳酸氢铵的化学式是 。
(2)由上表分析过程②中能发生反应的原因是 。
(3)过程③中反应的化学方程式是 。
I .海水提溴。从海水中提取的溴约占世界溴产量的
 ,工业上常用“吹出法”制溴,其工艺流程如下:
,工业上常用“吹出法”制溴,其工艺流程如下:
试回答:
(1)步骤②中的化学方程式为2NaBr+C12=2NaCl+Br2,其反应类型是 ,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:C12+2KBr=2KCl+Br2 Br2+2KI=2KBr2+I2
由此可判断C12、I2、Br2活动性由强到弱顺序是_______。
Ⅱ .食盐制碱。我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水。
四种盐在不同温度下的溶解度表:

请回答:
(1)碳酸氢铵的化学式是 。
(2)由上表分析过程②中能发生反应的原因是 。
(3)过程③中反应的化学方程式是 。
Ⅰ(1)置换反应
(2)Cl2、Br2、I2或Cl2>Br2>I2
Ⅱ(1)NH4HCO3
(2)在同温度下碳酸氢铵的溶解度小
(3)
(2)Cl2、Br2、I2或Cl2>Br2>I2
Ⅱ(1)NH4HCO3
(2)在同温度下碳酸氢铵的溶解度小
(3)

本题考查的是;置换反应及其应用以及化学式与化学方程式的书写。
Ⅰ(1)由反应的化学方程式可知该反应是一种单质与一种化合物反应生成一种新的单质和一种新的化合物,符合置换反应的定义,所以其反应类型属于置换反应。
(2)在金属活动性顺序中,位于前面的金属能把位于后面的金属从它的盐溶液中置换出来,而题目中介绍:非金属单质也具有类似金属与盐溶液之间的反应规律,即在非金属活动性顺序中,位于前面的非金属能把位于后面的非金属从它的盐溶液中置换出来,结合C12+2KBr=2KCl+Br2,Br2+2KI=2KBr2+I2可知Cl2>Br2>I2
Ⅱ(1)根据化学式的书写规律和读法规律,结合碳酸氢铵的名称,可知它由铵根和碳酸氢根组成,其中铵根显正一价,碳酸氢根显负一价,根据正价在前,负价在后,化合物中元素化合价的代数和为0,化学式应为:NH4HCO3
(2)由上表可看出在同温度下碳酸氢铵的溶解度小,能以不溶物的形式存在,相当于沉淀,而复分解反应的条件是生成物中有沉淀或水或气体中至少一样。所以过程②中能发生反应。
(3)由题意可知反应物为碳酸氢钠,生成物为碳酸钠、水、二氧化碳,条件为加热,据此可写出化学方程式。
Ⅰ(1)由反应的化学方程式可知该反应是一种单质与一种化合物反应生成一种新的单质和一种新的化合物,符合置换反应的定义,所以其反应类型属于置换反应。
(2)在金属活动性顺序中,位于前面的金属能把位于后面的金属从它的盐溶液中置换出来,而题目中介绍:非金属单质也具有类似金属与盐溶液之间的反应规律,即在非金属活动性顺序中,位于前面的非金属能把位于后面的非金属从它的盐溶液中置换出来,结合C12+2KBr=2KCl+Br2,Br2+2KI=2KBr2+I2可知Cl2>Br2>I2
Ⅱ(1)根据化学式的书写规律和读法规律,结合碳酸氢铵的名称,可知它由铵根和碳酸氢根组成,其中铵根显正一价,碳酸氢根显负一价,根据正价在前,负价在后,化合物中元素化合价的代数和为0,化学式应为:NH4HCO3
(2)由上表可看出在同温度下碳酸氢铵的溶解度小,能以不溶物的形式存在,相当于沉淀,而复分解反应的条件是生成物中有沉淀或水或气体中至少一样。所以过程②中能发生反应。
(3)由题意可知反应物为碳酸氢钠,生成物为碳酸钠、水、二氧化碳,条件为加热,据此可写出化学方程式。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目