题目内容
现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,某同学取该溶液34g于烧杯中,加入3g二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g.请根据要求回答下列问题:(1)加入二氧化锰后发生反应的化学方程式为
(2)生成氧气的质量是
(3)瓶内过氧化氢溶液中溶质的质量分数是
分析:(1)熟记常用的化学方程式.
(2)根据质量守恒定律,反应前后减少的质量为氧气的质量.
(3)过氧化氢溶液中溶质的质量分数=
×100%,过氧化氢溶液的质量已知,可根据氧气的质量求出过氧化氢的质量.
(2)根据质量守恒定律,反应前后减少的质量为氧气的质量.
(3)过氧化氢溶液中溶质的质量分数=
| 过氧化氢的质量 |
| 过氧化氢溶液的质量 |
解答:解:(1)过氧化氢以二氧化锰为催化剂生成水和氧气.故答案为:2H2O2
2H2O+O2↑
(2)34g+3g-33.8g=3.2g 故答案为:3.2
(3)设过氧化氢的质量为x
2H2O2
2H2O+O2↑
68 32
x 3.2g
=
x=6.8g
过氧化氢溶液中溶质的质量分数=
×100%=20%
答:过氧化氢溶液中溶质的质量分数为20%.
| ||
(2)34g+3g-33.8g=3.2g 故答案为:3.2
(3)设过氧化氢的质量为x
2H2O2
| ||
68 32
x 3.2g
| 68 |
| x |
| 32 |
| 3.2g |
x=6.8g
过氧化氢溶液中溶质的质量分数=
| 6.8g |
| 34g |
答:过氧化氢溶液中溶质的质量分数为20%.
点评:本题为最基本的根据化学方程式的计算题,解答本题的关键是根据质量守恒定律求出氧气的质量.

练习册系列答案
相关题目
 某同学欲配制溶质质量分数为3%的过氧化氢溶液作为消毒液.现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g,将杯内剩余物质过滤、洗涤、干燥后得滤渣3g.计算:
某同学欲配制溶质质量分数为3%的过氧化氢溶液作为消毒液.现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g,将杯内剩余物质过滤、洗涤、干燥后得滤渣3g.计算: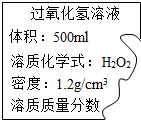 某同学欲配制溶质质量分数为3%的过氧化氢溶液作为消毒液.现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g,将杯内剩余物质过滤、洗涤、干燥后得滤渣3g.请根据要求回答下列问题:
某同学欲配制溶质质量分数为3%的过氧化氢溶液作为消毒液.现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g,将杯内剩余物质过滤、洗涤、干燥后得滤渣3g.请根据要求回答下列问题: 现有一瓶标签已破损的过氧化氢溶液,如图.为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g,将杯内剩余物质过滤、洗涤、干燥后得滤渣3g.请根据要求回答下列问题:
现有一瓶标签已破损的过氧化氢溶液,如图.为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g,将杯内剩余物质过滤、洗涤、干燥后得滤渣3g.请根据要求回答下列问题: (2011?静安区二模)现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取34g该溶液于分液漏斗A中,锥形瓶B中加入一定量的二氧化锰.不同时间电子天平的读数如下表所示(不考虑H2O逸出):
(2011?静安区二模)现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取34g该溶液于分液漏斗A中,锥形瓶B中加入一定量的二氧化锰.不同时间电子天平的读数如下表所示(不考虑H2O逸出):