题目内容
某化学兴趣小组在进行氧气的性质实验时,需要4瓶氧气(密度为 1.429g/L),每瓶氧气的体积为0.25L.现用分解过氧化氢溶液的方法制取氧气.请计算制取所需氧气至少需用5%的过氧化氢溶液多少克?(计算结果保留一位小数)
【答案】分析:根据题给的信息结合密度公式可以求算出氧气的质量,然后结合化学方程式可以求算出过氧化氢溶液的质量.
解答:解:根据题意可以知道需制取的氧气的质量为:0.25L×1.429g/L×4=1.429g
设应取用过氧化氢的质量为x.
2H2O2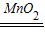 2H2O+O2↑
2H2O+O2↑
68 32
x 1.429g
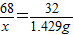
解得:x=3.04g
所以需用5%的过氧化氢溶液为:3.04g÷5%=60.8g
答:制取所需氧气至少需用5%的过氧化氢溶液60.8g.
点评:本题为根据化学方程式的基础计算,正确书写化学方程式、规范的计算步骤、准确的计算结果是解答时注意的关键.
解答:解:根据题意可以知道需制取的氧气的质量为:0.25L×1.429g/L×4=1.429g
设应取用过氧化氢的质量为x.
2H2O2
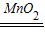 2H2O+O2↑
2H2O+O2↑68 32
x 1.429g
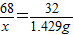
解得:x=3.04g
所以需用5%的过氧化氢溶液为:3.04g÷5%=60.8g
答:制取所需氧气至少需用5%的过氧化氢溶液60.8g.
点评:本题为根据化学方程式的基础计算,正确书写化学方程式、规范的计算步骤、准确的计算结果是解答时注意的关键.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
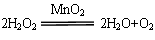 )试求:
)试求: