题目内容
【题目】海边盛产贝壳,其主要成分为CaCO3.。某化学兴趣小组称取4.0g贝壳样品,把50g稀盐酸分5次加入样品中(假设杂质不反应也不溶解),
得实验数据如下: 稀盐酸的用量 剩余固体的质量
第一次加入 10g 3.0g
第二次加入 10g 2.0g
第三次加入 10g 1.0g
第四次加入 10g 0.8g
第五次加入 10g 0.8g
请计算:(1)贝壳中碳酸钙的质量分数是____。(2)这些贝壳最多可制得多少克二氧化碳____?
【答案】80% 1.4g
【解析】
(1)前三次每加入10g盐酸固体减少1.0g,也就是每10g盐酸恰好和1.0g碳酸钙完全反应。而第四次只减少了0.2g,说明剩余物质不能和盐酸反应,碳酸钙已经完全反应,所以碳酸钙的质量为4.0g-0.8g=3.2g,贝壳中碳酸钙的质量分数=![]() 。
。
(2)设贝壳最多可制得二氧化碳的质量为x。
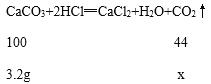
![]() x≈1.4g。
x≈1.4g。
答:(1)贝壳中碳酸钙的质量分数是80%。
(2)这些贝壳最多可制得1.4g二氧化碳。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
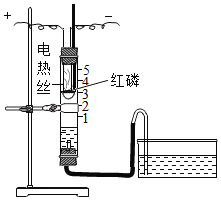
【题目】利用如图装置进行空气中氧气含量测定实验。
实验装置 | 实验操作 |
| I.向玻璃管和水槽内加适量的水,在燃烧匙里放足量红磷,塞紧塞子,上下移动水槽至两边水面相平于玻璃管的零刻度位置。 II.接通电源,待红磷燃烧,断开电源。 III.当温度恢复至室温,水不再进入玻璃管时,上下移动水槽至两边水面相平。 |
(1)实验中加入足量红磷的目的是_____,该实验中发生反应的化学方程式为_____。
(2)实验结束后,玻璃管内水面最终到达刻度线_____(填数字序号)处。
(3)实验操作I、III中,上下移动水槽至两边水面相平的目的是_____。