题目内容
取含铁、氧两种元素的固体样品11.6g,通入足量CO并充分加热,将产生的气体通入足量澄清石灰水,充分反应后,得沉淀20.0g。该固体的组成不可能是
| A.Fe2O3 | B.Fe3O4 | C.Fe和FeO | D.FeO和Fe2O3 |
A
解析试题分析:铁的氧化物有: Fe3O4、FeO和Fe2O3 ,分别与CO反应生成CO2;一个一氧化碳分子结合一个氧原子生成一个二氧化碳分子;二氧化碳与氢氧化钙反应生成碳酸钙沉淀;由各化学方程式可知,Fe3O4、FeO和Fe2O3与碳酸钙的个数关系分别为:Fe3O4-4CaCO3;FeO-CaCO3;Fe2O3-3CaCO3;已知碳酸钙20.0g,计算出各铁的氧化物的质量依次为:11.6、14.4、10.1;又因为铁不能发生上述反应;与11.6g相比较;用平均值观点分析数据可知,该固体样品不可能是A.
考点:化学方程式计算;混合物成分的确定

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
将18g高锰酸钾加热,当产生1.6g氧气时,固体剩余物是 ( )
| A.KMnO4 MnO2 | B.K2MnO4 MnO2 |
| C.KMnO4 MnO2 K2MnO4 | D.KMnO4 K2MnO4 |
甲和乙反应可制备燃料丙,其微观示意图如下.下列说法错误的是( )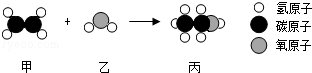
| A.该反应属于化合反应 | B.该反应中分子和原子的种类都发生了改变 |
| C.甲、丙是有机物,乙是氧化物 | D.甲、丙分别在氧气中完全燃烧,产物相同 |
质量相同的下列金属,分别加入到足量的稀硫酸中充分反应,放出氢气最多的是 ( )
| A.Na | B.Al | C.Cu | D.Zn |