题目内容
【题目】将5%的NaOH溶液逐滴加入到20克稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示,请计算: 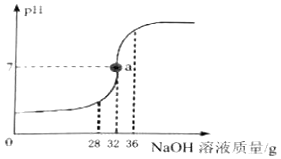
(1)当恰好完全反应时,消耗NaOH溶液的质量为克;
(2)请计算稀盐酸中溶质的质量分数(写出计算过程).
【答案】
(1)32
(2)解:设消耗的HCl的质量为x
NaOH+ | HCl=NaCl+H2O |
40 | 36.5 |
1.6g | x |
![]() =
= ![]()
x=1.46g
稀盐酸中溶质的质量分数为 ![]() ×100%=7.3%
×100%=7.3%
答:稀盐酸中溶质的质量分数为7.3%
【解析】解:由图可以看出,pH=7时也就是恰好完全反应时消耗的氢氧化钠溶液的质量为32g.所含溶质的质量为32g×5%=1.6g
答:当恰好完全反应时,消耗NaOH溶液的质量为 32克;
根据pH=7时消耗的氢氧化钠溶液的体积可求消耗的氢氧化钠的质量,进而根据对应的化学方程式和质量守恒定律求算消耗的HCl的质量和对应的质量分数.

练习册系列答案
相关题目