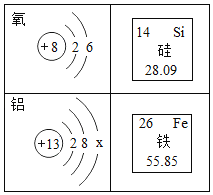
题目内容
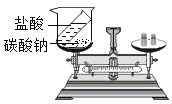
【题目】鸡蛋壳的主要成分是碳酸钙。为了测定某鸡蛋壳中碳酸钙的质量分数,某同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取12克 放在烧杯里,然后往烧杯中加入足量的稀盐酸100克,充分反应后,称得反应剩余物为107.6克(假设鸡蛋壳中的其它物质不与稀盐酸反应)。计算:
(1)产生二氧化碳气体多少克。________________
(2)计算该鸡蛋壳中碳酸钙的质量分数。________________
(3)稀盐酸的溶质质量分数。________________
(4)生成氯化钙的质量。________________
【答案】4.4g 83.3% 7.3% 11.1g
【解析】
(1)产生二氧化碳气的质量为:12g+100g-107.6g=4.4g;故填:4.4g;
(2)解:设12g样品中碳酸钙的质量为x,氯化氢的质量为y,生成氯化钙的质量为z
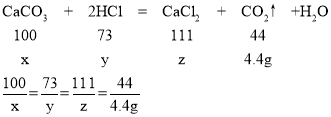
解得x=10g,y=7.3g,z=11.1g;
该鸡蛋壳中碳酸钙的质量分数为:![]() ;
;
答:该鸡蛋壳中碳酸钙的质量分数为83.3%;
(3)稀盐酸的溶质貭量分数为:![]() ;
;
答:稀盐酸的溶质貭量分数为7.3%;
(4)生成氯化钙的质量为11.1g。

练习册系列答案
相关题目