题目内容
鸡蛋壳的主要成分是碳酸钙.为了测定鸡蛋壳中碳酸钙的质量分数,小华同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取10g放在烧杯里,然后往烧杯中滴加足量的稀盐酸(假设鸡蛋壳中其他物质不与盐酸反应),加入稀盐酸的量与生成气体的量如图所示.试求:
(1)该鸡蛋壳中碳酸钙的质量分数.
(2)所用稀盐酸的溶质质量分数.
解:设鸡蛋壳中碳酸钙的质量是x,参加反应的盐酸的质量是y
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 73 44
x y 2.2g
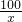 =
=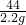 x=5g
x=5g
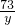 =
=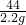 y=3.65g
y=3.65g
(1)鸡蛋壳中碳酸钙的质量分数为: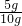 ×100%=50%
×100%=50%
(2)所用稀盐酸的溶质质量分数为: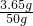 ×100%=7.3%
×100%=7.3%
答:(1)该鸡蛋壳中碳酸钙的质量分数是50%;
(2)所用稀盐酸的溶质质量分数是7.3%.
分析:依据图示,当加入50g稀盐酸时,放出气体的质量最多,此后保持不变,说明50g稀盐酸与鸡蛋壳中的碳酸钙恰好反应,生成2.2g的二氧化碳,据此结合方程式可以计算出碳酸钙的质量,参加反应的盐酸溶质的质量,从而计算出碳酸钙的质量分数和稀盐酸的溶质质量分数.
点评:本题考查了学生根据图象分析解决问题的能力,在解答此类题时,要注意观察图象的起点、终点、转折点、变化趋势,即‘三点一趋势’,通常图象的转折点是物质恰好反应的点,据此结合方程式分析解答.
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 73 44
x y 2.2g
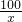 =
=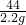 x=5g
x=5g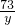 =
=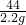 y=3.65g
y=3.65g(1)鸡蛋壳中碳酸钙的质量分数为:
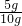 ×100%=50%
×100%=50%(2)所用稀盐酸的溶质质量分数为:
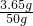 ×100%=7.3%
×100%=7.3%答:(1)该鸡蛋壳中碳酸钙的质量分数是50%;
(2)所用稀盐酸的溶质质量分数是7.3%.
分析:依据图示,当加入50g稀盐酸时,放出气体的质量最多,此后保持不变,说明50g稀盐酸与鸡蛋壳中的碳酸钙恰好反应,生成2.2g的二氧化碳,据此结合方程式可以计算出碳酸钙的质量,参加反应的盐酸溶质的质量,从而计算出碳酸钙的质量分数和稀盐酸的溶质质量分数.
点评:本题考查了学生根据图象分析解决问题的能力,在解答此类题时,要注意观察图象的起点、终点、转折点、变化趋势,即‘三点一趋势’,通常图象的转折点是物质恰好反应的点,据此结合方程式分析解答.

练习册系列答案
相关题目